
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是( )
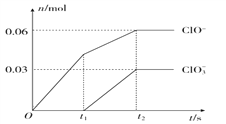
A. 反应中转移电子的物质的量是0.21mol
B. 一定有3. 36L氯气参加反应
C. 苛性钾溶液中KOH的质量是16.8g
D. ClO的生成可能是由于温度升高引起的
【答案】B
【解析】A.氯气和氢氧化钠溶液反应生成次氯酸钠、氯化钠和氯酸钠,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,故转移电子物质的量=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故A正确;B.根据氯原子守恒可知参加反应的氯气为0.15mol,氯气的状态未知,不能确定其体积,故B错误;C.根据电子转移守恒可知n(Cl-)=0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,则n(KOH)=0.3mol,则氢氧化钾质量=0.3mol×56g/mol=16.8g,故C正确;D.根据图象知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾,所以氯酸根离子的生成是由于温度升高引起的,故D正确;故答案为B。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( ) 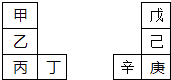
A.金属性:甲>乙>丁
B.原子半径:辛>戊>甲
C.丙与庚的元素原子核外电子数相差13
D.形成的最简单氢化物的稳定性:己>戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3在现代工业生产应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
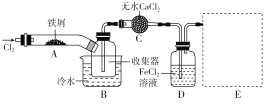
①检验装置的气密性; ②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成; ④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为____________________________________________。
(2)在③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是________。
(3)操作步骤中,为防止FeCl3潮解而采取的措施有(填步骤序号)________。
(4)装置B中冷水浴的作用为________;装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂____________。通常保存FeCl2溶液时要加入_______以防止被氧化,有关反应的离子方程式为________。
(5)在虚线框中画出尾气吸收装置E并注明试剂________。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:
(1)①将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈;与盐酸反应的速度最慢;与盐酸反应产生的气体最多.
②向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为 .
(2)利用图装置可验证同主族元素非金属性的变化规律 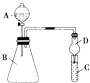
①仪器B的名称为 , 干燥管D的作用为防止 .
②若要证明非金属性:Cl>I,则A中加浓盐 酸,B中加KMnO4 , (KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C溶液中现象为 , 即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是( )
A. AlCl3和NaOH B. Fe和Cl2 C. Na和O2 D. Na2CO3和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A和B是同周期的相邻元素,B和C是同主族的相邻元素,且A,B,C最外层电子数之和为19,则A,B,C三种元素按照顺序是( )
A.N,F,Cl
B.F,O,S
C.S,Cl、O
D.S,O,F
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4和Cu(NO3)2是自然界中重要的铜盐。请回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子的核外价电子排布式为_______,S、O、N三种元素的第一电离能由大到小的顺序为 __________。
(2)NO3-的立体构型是_____,与NO3-互为等电子体的一种非极性分子为 _________(填化学式)。
(3)CuSO4的熔点为560°C,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是_____。
(4)往CuSO4溶液中加人过量NaOH能生成配合物[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为(用箭头表示出配位键的位置)_______。
(5)化学实验室常利用新制氢氧化铜检验醛基的存在,乙醛分子中碳原子的杂化方式为 ___。
(6)利用新制的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如下图所示。
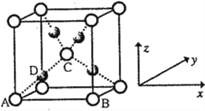
该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(![]() ,
, ![]() ,
, ![]() )。则D原子的坐标参数为________,它代表_______原子。
)。则D原子的坐标参数为________,它代表_______原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨作电极电解下列溶液
①稀H2SO4②K2SO4溶液 ③NaCl溶液 ④CuSO4溶液 ⑤KOH溶液
(1)阴极、阳极都有气体产生,且体积比(相同条件下)为2∶1的是(填序号)_______。
(2)阴极、阳极都有气体产生,其中溶液pH变大的是________。(填序号)
(3)一个电极析出金属,一个电极逸出气体,且溶液pH明显减小的是________ (填序号),其总反应的化学方程式是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com