
【题目】在恒温恒容的密闭容器中,有可逆反应:![]() 。下列不能说明反应已达到平衡状态的是( )
。下列不能说明反应已达到平衡状态的是( )
A.![]()
B.反应器中的压强不随时间的变化而变化
C.混合气体的颜色保持不变
D.混合气体的平均相对分子质量保持不变
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.配置一定浓度的稀硫酸,用量筒量取浓硫酸后,未将蒸馏水洗涤量筒后的洗涤液转移至容量瓶中,会使配置的溶液浓度偏小
B.提纯混有少量硝酸铵的氯化钠,应采用在较高温度下制得浓溶液,再采取冷却结晶、过滤、干燥的方法
C.蒸发时将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热
D.石油的蒸馏实验中,忘记加沸石,可以先停止加热,待溶液冷却后加入沸石,在继续加热蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种重要的化工原料,可由H2与CO或CO2反应制备,主要用于制备羧基甲酯等。
(1)水杨酸甲酯是无色透明油状液体,密度为1.54g·cm-3,常作为医药制剂的赋香剂。制备及提纯水杨酸甲酯的实验步骤如下:
步骤1.在三口烧瓶中加入3.5g(0.025mol)水杨酸 、15mL(0.375mol)甲醇、1mL浓硫酸,几粒沸石,在85~95℃加热回流1.5h(装置如图所示)。
、15mL(0.375mol)甲醇、1mL浓硫酸,几粒沸石,在85~95℃加热回流1.5h(装置如图所示)。

步骤2.向回收甲醇后剩余液中加入10mL水,振荡、静置,分液出有机相。
步骤3.有机相依次用水、10%Na2CO3溶液、水洗涤。
步骤4.干燥,蒸馏并收集221~224℃馏分。
①图中仪器W的名称是___。
②步骤3,第一次水洗的主要目的是___;第二次水洗的目的是___。
③合成水杨酸甲酯的化学方程式为___;实验中加入过量甲醇的目的是___。
(2)工业上制备甲醇的主要反应有:
(Ⅰ)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1 平衡常数K1
CH3OH(g)+H2O(g) ΔH1 平衡常数K1
(Ⅱ)CO(g)+2H2(g)![]() CH3OH(g) ΔH2 平衡常数K2
CH3OH(g) ΔH2 平衡常数K2
(Ⅲ)CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3 平衡常数K3
CO(g)+H2O(g) ΔH3 平衡常数K3
维持![]() =75:25,CO、CO2以及n(CO2):n(CO)=1:2,用不同催化剂时甲醇的产率随温度的变化如图所示:
=75:25,CO、CO2以及n(CO2):n(CO)=1:2,用不同催化剂时甲醇的产率随温度的变化如图所示:

①平衡常数K3=___(用K1、K2表示);△H1___0(填“>"或“<”)。
②下列叙述正确的是___ (填标号)。
A.催化剂Cu/ZnO不能催化反应(I)
B.催化剂Cu/ZnO在温度低于480K时活性很低
C.图中a点所示条件下,延长反应时间能提高甲醇的产率
D.图中b点所示条件下,若增加H2的浓度不能提高甲醇的产率
③400K时向某恒容密闭容器中充入CO和H2,使c(CO)=0.10mol·L-1,c(H2)=0.20mol·L-1,且只发生反应(II);平衡时c(CH3OH)=0.08mol·L-1。该温度下反应(II)的平衡常数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯甲酸的酸性比碳酸强,苯酚的酸性比碳酸弱。则可将 转变为
转变为 的方法是( )
的方法是( )
①与足量的NaOH溶液共热,再通入CO2 ②与稀硫酸共热后,加入足量的NaOH溶液 ③加热溶液,通入足量的SO2 ④与稀H2SO4共热后,加入足量的NaHCO3
A.①②
B.①④
C.②③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】数十年来,化学工作者对碳的氧化物和氢化物做了广泛深入的研究并取得了一些重要成果。已知:C(s)+O2(g)=CO2(g);ΔH=-393 kJ·mol-1
2CO (g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(g);ΔH=-484 kJ·mol-1
(1)工业上常采用将水蒸气喷到灼热的炭层上实现煤的气化(制得CO、H2),该反应的热化学方程式是_______________。
(2)上述煤气化过程中需向炭层交替喷入空气和水蒸气,喷入空气的目的是__________;该气化气可在加热和催化剂下合成液体燃料甲醇,该反应方程式为_______________。
(3)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) === HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) === CH3OH(g) +CO(g) △H>0
则以甲醇制一氧化碳的反应为___________反应(填“吸热”、“放热”)。
(4)科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以
CO2和H2O合成CH4。
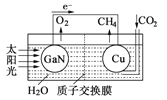
①写出铜电极表面的电极反应式____________。
②为提高该人工光合系统的工作效率,可向装置中加入少量___________(选填“氢氧化钠”或“硫酸”)。
(5)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图,则X的结构简式为_____________。
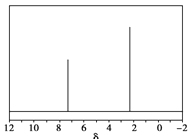
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的一组是( )
![]() 糖类、油脂、蛋白质在一定条件下都能发生水解
糖类、油脂、蛋白质在一定条件下都能发生水解
![]() 除去乙酸乙酯中残留的乙酸,可加过量饱和Na2CO3溶液振荡后,静置分液
除去乙酸乙酯中残留的乙酸,可加过量饱和Na2CO3溶液振荡后,静置分液
![]() 石油的分馏、裂化和煤的干馏都是化学变化
石油的分馏、裂化和煤的干馏都是化学变化
![]() 检验溴乙烷中溴原子的方法是将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液
检验溴乙烷中溴原子的方法是将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液
![]() 淀粉遇碘酒变蓝色,葡萄糖能与新制Cu(OH)2发生反应
淀粉遇碘酒变蓝色,葡萄糖能与新制Cu(OH)2发生反应
![]() 塑料、橡胶和纤维素都是合成高分子材料
塑料、橡胶和纤维素都是合成高分子材料
![]() 向蛋白质溶液中加入饱和Na2SO4溶液,出现盐析现象,加水溶解
向蛋白质溶液中加入饱和Na2SO4溶液,出现盐析现象,加水溶解
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇( )广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性。回答下列问题:
)广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性。回答下列问题:
(1)关于它的说法正确的是________。
a.可使酸性KMnO4溶液褪色
b.可与FeCl3溶液作用显紫色
c.可使溴的CCl4溶液褪色
d.可与NH4HCO3溶液作用产生气泡
e.它属于醇类
(2)1 mol 该化合物最多消耗________ mol NaOH。
(3)1 mol 该化合物与Br2反应时,最多消耗________ mol Br2。
(4)1 mol该化合物与H2加成时,最多消耗标准状况下的H2的体积为________ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH3Cl(g)+Cl2(g)![]() CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0
CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0
B.室温下,稀释0.1mol·L-1NH4Cl溶液,溶液中![]() 增大
增大
C.向稀氨水中加入少量氯化铵固体,一水合氨的电离程度增大
D.向硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,向沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com