
| A、硫酸、纯碱、石灰石 |
| B、醋酸、烧碱、硫酸铜 |
| C、磷酸、熟石灰、苛性钾 |
| D、盐酸、酒精、醋酸钠 |
科目:高中化学 来源: 题型:
| A、植物光合作用 |
| B、用四氯化碳可擦去圆珠笔油 |
| C、自来水厂用液氯消毒 |
| D、可用食醋洗掉水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 反应的H2或溴水中Br2的最大量分别是( )
反应的H2或溴水中Br2的最大量分别是( )| A、11mol,9mol |
| B、9 mol,6mol |
| C、6mol,5 mol |
| D、l3 mol,9mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH2=CH-CH=CH2 |
| B、CH2=CH-CH3 |
| C、CH2=CH2 |
| D、以上答案均不合理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 稀硫酸 |
| △ |
| 一定条件 |
| 试剂X |
| NaOH溶液 |
| △ |
| [O] |
| H2O |
| [O] |
| [O] |
| KMnO4 |
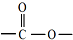 ,且无环状结构的同分异构体有
,且无环状结构的同分异构体有查看答案和解析>>
科目:高中化学 来源: 题型:
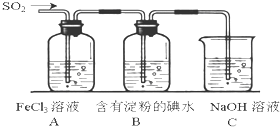 某校化学兴趣小组为探究SO2气体的还原性设计了如下装置图:
某校化学兴趣小组为探究SO2气体的还原性设计了如下装置图:查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| ① | KNO3溶液 | KOH | 加入FeCl3溶液,并过渡 |
| ② | Al2(SO4)3溶液 | MgSO4 | 加入过量烧碱后过滤,再用硫酸酸化滤液 |
| ③ | CO2 | SO2 | 通过盛KMnO4(H+)溶液烧洗气瓶,再通过浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 溶解、过滤、蒸发结晶 |
| A、①②④ | B、③④ |
| C、②③④ | D、①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com