
某研究性学习小组用HNO3与大理石反应,探究影响反应速率的因素。所用HNO3浓度为1.00mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 编号 | T/K | 大理石规格 | HNO3浓度 /mol·L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00[ | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 探究温度对该反应速率的影响; (Ⅲ)实验①和 探究大理石规格(粗、细)对该反应速率的影响。 |
| ② | 298] |
|
| |
| ③ | 308 |
|
| |
| ④ | 298 |
|
|
(2)实验①中CO2的物质的量随时间变化的关系见图:
计算在70-90 s范围内HNO3的平均反应速率v(HNO3)= 。(忽略溶液体积变化,不需要写出计算过程)。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 实验编号 | 氨水物质的量浓度 (mol?L-1) |
盐酸物质的量浓度 (mol?L-1) |
混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | C | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省南阳市一中高二第一次月考化学试卷(带解析) 题型:实验题
(10分)某研究性学习小组用电解 溶液的方法测定铜的相对原子质量(装置如图),实验中测得某电极的质量增重为m g,已知氧元素相对原子质量为16。请回答:
溶液的方法测定铜的相对原子质量(装置如图),实验中测得某电极的质量增重为m g,已知氧元素相对原子质量为16。请回答: 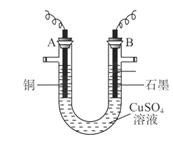
(1)m g应为 极的质量增重(填A或B),电解总反应的离子方程式为 ;
(2)本实验(电解 溶液)中,学习小组采用两套方案测定铜的相对原子质量。
溶液)中,学习小组采用两套方案测定铜的相对原子质量。
①第一套方案中,同学们测得气体的体积为V L(标准状况),则铜的相对原子质量是(用m、V表示) ;
②第二套方案中,以下数据需要测定的是(填序号) 。
a. A极增加的质量 b. 整套装置减少的质量
c. 电解后溶液的体积 d. 电解后溶液的pH(可由此计算出溶液中H+的物质的量浓度)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省深圳市直属六校高三第二次联考(2月)理综化学试卷(解析版) 题型:实验题
某兴趣小组设计并进行了以下实验来制取氯水,并利新制用氯水完成实验。
(1)实验室拟用下列装置制备氯水,请按照气体从左向右流动的方向将仪器进行连接:
H→ _____________(填接口处的符号);广口瓶Ⅱ中的试剂为 。

(2)写出该实验中制取Cl2的化学方程式为:___________________________________
(3)某兴趣小组设计实验除去氯化钾中含有Fe3+、SO42-、Br-等杂质离子,步骤如下:
A.溶解,在所得溶液中加入试剂至Fe3+、SO42-沉淀完全,煮沸;
B.过滤,在滤液中加入盐酸调节pH;
C.加入_____(除Br-);蒸干灼烧。请回答问题:
(3)①步骤a中,依次加入的试剂是NH3.H2O、_________、_________。
②步骤c中加入的试剂是__________________。
(4)某研究性学习小组用KSCN检验FeSO4溶液中的Fe2+时,加入过量浓HNO3,溶液的颜色变红。但是将红色溶液放置一会则发现溶液由红色突然变为蓝色,并产生红棕色气体。对这一奇特现象同学们进行了以下探究。
[查阅资料]:
(SCN)2称为拟卤素,性质与卤素单质相似,(SCN)2、Cl2、Br2、I2四种物质的氧化性强弱为:Cl2>Br2>(SCN)2>I2。
[提出假设]:
①甲同学假设是FeSO4与HNO3作用;乙同学假设是______与HNO3作用。
[实验验证]:
②大家经过理性分析,认为甲同学的假设不成立。理由是________________________。
③根据乙同学的假设,设计了如下实验方案进行验证:向浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深色,突然剧烈反应产生大量气泡,放出红棕色气体。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(是空气中的主要成分之一);向反应后的溶液中加入BaCl2溶液产生白色沉淀。
则反应中产生的气体是:_______________________________
[实验结论]:乙同学假设正确。
[实验反思]:
④由实验可知:用SCN-间接检验Fe2+时,加入的氧化剂除用HNO3外还可以选择氯水等,通过该实验探究可知加入氧化剂的量必须要_______(填“少量”、“过量”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com