
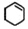
 )为原料合成,路线如下(部分反应条件省略):
)为原料合成,路线如下(部分反应条件省略):



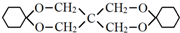 .
. .
.分析 由X的结构简式和D的分子式可知,D为CH2=CHCOOH,F为C(CH2OH)4,根据转化关系A发生信息Ⅱ中的反应生成E,E发生加成反应生成F,所以A为CH3CHO,E为(CH2OH)3CCHO,根据D的结构简式可逆推得A与甲醛发生信息Ⅱ中的反应生成B为HOCH2CH2CHO,B发生消去反应生成C为CH2=CHCHO,C发生氧化反应得D,环己烯与HBr发生加成反应生成G为 ,G在氢氧化钠水溶液、加热条件下发生水解得H为
,G在氢氧化钠水溶液、加热条件下发生水解得H为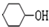 ,环已醇发生氧化反应得环已酮,根据Y的分子式可知,环已酮与F发生信息Ⅲ中的反应得Y为
,环已醇发生氧化反应得环已酮,根据Y的分子式可知,环已酮与F发生信息Ⅲ中的反应得Y为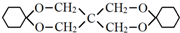 ,以此来解答.
,以此来解答.
解答 解:(1)X的结构简式为 ,可知其分子式为C17H20O8,A为CH3CHO其官能团为醛基,第①步反应,发生信息ii中的反应,甲醛中C=O键转化为单键,为加成反应,
,可知其分子式为C17H20O8,A为CH3CHO其官能团为醛基,第①步反应,发生信息ii中的反应,甲醛中C=O键转化为单键,为加成反应,
故答案为:C17H20O8;醛基;加成反应;
(2)a.H为环己醇,只有苯酚与氯化铁发生显色反应,可以用FeCl3溶液区分,故选;
b.G、H分别经一步反应都可得到环己烯,均发生消去反应,但条件不同,故选;
c. D为CH2=CHCOOH,D的所有同分异构体为CH2=CHOOCH、OHCCH2CHO等,含有的官能团或基团不同,在红外光谱仪中显示的信号(或数据)不完全相同,故不选;
d.G在氢氧化钠水溶液、加热条件下发生水解得H为 ,试剂a是NaOH溶液,故不选;
,试剂a是NaOH溶液,故不选;
e.反应②发生醇的消去反应,需要浓硫酸,不能加高锰酸钾,故不选;
故答案为:ab;
(3)Y的结构简式是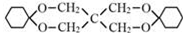 ,
,
故答案为: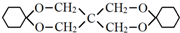 ;
;
(4)1mo1W与1mol H2经加成反应生成1molE,W的同分异构体能同时满足下列条件:①能与饱和NaHCO3溶液反应产生气体,说明含有羧基,②既能发生银镜反应,又能发生水解反应,含有甲酸形成的酯基,③核磁共振氢谱显示为3组峰,且峰面积比为6:1:1,含2个甲基,符合条件的W的同分异构体结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物的合成,为高频考点,把握习题中的信息、合成流程中官能团的变化、官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意同分异构体书写为解答的难点,题目难度不大.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油分馏、海水晒盐、燃煤烟气的脱硫、菜籽中提取菜籽油等过程都是物理变化 | |
| B. | CO2可与H2在一定条件下转化为CO、CH3OH、CH3OCH3、HCOOH以及各种低碳烃,这些措施符合低碳经济的发展要求 | |
| C. | 泡过高锰酸钾溶液的硅藻土放于新鲜水果箱内是为了催熟水果 | |
| D. | 生活中常用可溶性铝盐和铜盐净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度/mol•L-1 时间/min | c(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | 4.5 | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |

 、
、 、
、 、
、 分别表示N2、NO2、O2和固体催化剂,则在固体催化剂表面分解NO的过 程可用图2表示:
分别表示N2、NO2、O2和固体催化剂,则在固体催化剂表面分解NO的过 程可用图2表示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 向25mL沸水中滴入5~6滴饱和FeCl3溶液,持续长时间加热并搅拌 | 制备Fe(OH)3胶体 |
| B | 用pH试纸测定同温度同浓度的NaC1O溶液和NaCN溶液的pH | 比较HClO、HCN的酸性强弱 |
| C | 向植物油和矿物油中分别加入烧碱溶液,加热 | 鉴别植物油和矿物油 |
| D | 向盛有体积相同浓度均为0.1mol/LH2O2溶液的两支试管中,分别滴加FeCl3溶液和CuSO4溶液各1mL | 比较Fe3+和Cu2+对H2O2催化分解的效果 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的或结论 |
| A | 将少量AgNO3溶液滴加到含有Cl-、CrO42-的溶液 | 确定Ksp(AgCl)、Ksp(Ag2CrO4)的相对大小 |
| B | 将C2H5OH与浓H2SO4在蒸馏烧瓶中混合后加热至170℃,将从瓶内逸出的物质依次通过NaOH溶液、溴水 | 检验有无乙烯生成 |
| C | 将铁与稀硝酸混合,充分反应后再向溶液中加入KSCN溶液 | 探究铁能否被氧化成Fe3+ |
| D | 向FeBr2溶液加入少量氯水,观察溶液是否变黄色 | 确定Fe2+与Br-还原性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,向水中加入少量固体NaHSO4,c(H+)增大,Kw不变 | |
| B. | 向0.1 mol•L-1CH3COOH溶液中加入少量的CH3COONa晶体,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$减小 | |
| C. | 常温下,向BaCO3饱和溶液中加入Na2CO3固体,c(Ba2+)减小,BaCO3的Ksp减小 | |
| D. | 一定条件下,将一定浓度的CH3COONa溶液加水稀释,溶液中所有离子的浓度都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L H2S溶液中:c(H+):c(S2-)=2:1 | |
| B. | 加水稀释CH3COOH稀溶液,Ka(CH3COOH)增大 | |
| C. | 加热蒸馏水,蒸馏水的pH减小 | |
| D. | 稀释NH4Cl溶液,NH4+的水解程度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铝是一种重要的金属.在生产、生活中具有许多重要的用途,图是从铝土矿中制备铝的工艺流程.已知:
铝是一种重要的金属.在生产、生活中具有许多重要的用途,图是从铝土矿中制备铝的工艺流程.已知:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com