
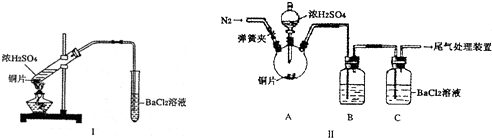
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | |
| 第一次称量 | 第二次称量 | ||
| 11.710g | 22.700g | 18.621g | a |
| 4.08g |
| 18g/mol |
| 6.910g |
| 160g/mol |
| ||
| 1 |
| 0.0432mol |
| x |
| 0.227 |
| 5.25-5 |
| 5 |


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学在探究常见物质转化时,发现部分物质间可存在如图所示的三角转换关系.已知:
某同学在探究常见物质转化时,发现部分物质间可存在如图所示的三角转换关系.已知:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、曲线a表示氯离子 |
| B、曲线b表示碳酸根离子 |
| C、曲线c表示钠离子 |
| D、曲线d表示碳酸氢根离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KSCN |
| B、BaCl2 |
| C、NaOH |
| D、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C+H2O═CO+H2 △H═+131.3KJ?mol-1 |
| B、C(s)+H2O(g)═CO(g)+H2(g)△H=+10.94KJ?mol-1 |
| C、C(s)+H2O(l)═CO(g)+H2(g)△H=+131.3KJ?mol-1 |
| D、C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3KJ?mol- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙酸异丁子香酚酯是一种有丁香及康乃馨香气的白色结晶.常用作调制丁香等花型香精,添加在化妆品及肥皂等中.其分子结构式为如图,下列有关说法不正确的是( )
乙酸异丁子香酚酯是一种有丁香及康乃馨香气的白色结晶.常用作调制丁香等花型香精,添加在化妆品及肥皂等中.其分子结构式为如图,下列有关说法不正确的是( )| A、1mol乙酸异丁子香酚酯水解时可消耗2molNaOH |
| B、能使溴水、高锰酸钾溶液褪色 |
| C、乙酸异丁子香酚酯分子中至少有12个原子共平面 |
| D、一定条件下,最多可与5摩尔H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 |
| n(SO3)/mol | 1.6 | a |
| 反应物的转化率 | α1 | α2 |
| A、α1+α2>1 |
| B、1.6<a<3.2 |
| C、若甲中反应2 min时达到平衡,则2 min 内平均速率ν(O2)=0.2 mol?L-1?min-1 |
| D、甲平衡后再加入0.2molSO2、0.2molO2和0.4 molSO3,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| 催化剂 |
| △ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com