
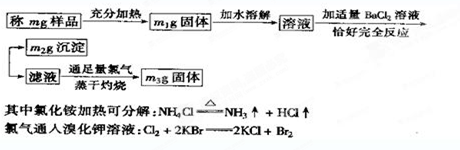
| (m-m1)g |
| mg |
| 100(m-m1) |
| m |
| m2g |
| 233g/mol |
| 174m2 |
| 233 |
| ||
| mg |
| 174m2 |
| 233m |
| 174 |
| 233 |
| 149 |
| 233 |
| 149 |
| 233 |
| 174 |
| 233 |
| 149 |
| 233 |
| 174 |
| 233 |
| 149 |
| 233 |
| 238 |
| 89 |
| 25 |
| 233 |
| 238 |
| 89 |
(m1-
| ||||
| mg |
(m1-
| ||||
| m |
| 100(m-m1) |
| m |
| 174m2 |
| 233m |
(m1-
| ||||
| m |


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
| A、铝与盐酸反应:Al+6H+═Al3++3H2↑ |
| B、少量CO2通入Ca(OH)2溶液中:CO2+2OH-═CO32-+H2O |
| C、氢氧化钠溶液与盐酸反应:NaOH+H+═H2O+Na+ |
| D、碳酸钠与氯化钙混合:CO32-+Ca2+═CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的
将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的| A、2mol、3mol、6mol |
| B、3mol、2mol、6mol |
| C、2mol、3mol、4mol |
| D、3mol、2mol、2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4 C2H4 |
| B、CH3OH CH3COOH |
| C、C2H6 HCHO |
| D、HCHO CH3COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | ① | ② | ③ | ④ |
| V[FeCl3(aq)]/mL | 50 | 50 | 50 | 50 |
| 混合粉末质量/g | 1.2 | 2.4 | 3.6. | 4.8 |
| 反应后剩余固体质量/g | 0 | 0.64 | 1.92 | 3.12 |
| A、第①组反应后溶液中剩余c(Fe3+)=0.4mol/L |
| B、第②、③组剩余固体全是铜 |
| C、第④组的滤液中c(Fe2+)=2.0mol/L |
| D、原混合粉末中n(Fe):n(Cu)=1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
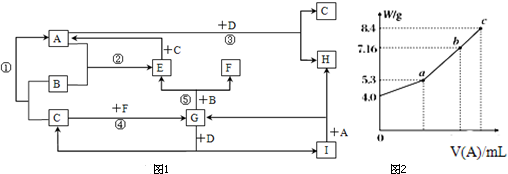
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钙和锌 | B、镁和铜 |
| C、铝和镁 | D、锌和铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中Cu2+向阳极移动,Cl-向阴极移动 |
| B、阳极上发生还原反应,阴极上发生氧化反应 |
| C、阴极反应:Cu2++2e-=Cu |
| D、可以用湿润的KI淀粉试纸检验阴极产生气体为Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 3 |
| A、22.2% |
| B、27.5% |
| C、33.3% |
| D、36.8% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com