
【题目】下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
A.CO(g)+ ![]() O2(g)═CO2(g);△H=﹣283.0 kJ/mol
O2(g)═CO2(g);△H=﹣283.0 kJ/mol
B.C(s)+ ![]() O2(g)═CO(g);△H=﹣110.5 kJ/mol
O2(g)═CO(g);△H=﹣110.5 kJ/mol
C.H2(g)+ ![]() O2(g)═H2O(g);△H=﹣241.8 kJ/mol
O2(g)═H2O(g);△H=﹣241.8 kJ/mol
D.2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l);△H=﹣11036 kJ/mol
科目:高中化学 来源: 题型:
【题目】在一个氧化还原反应体系中反应物、生成物共六种粒子,Fe3+、NO![]() 、Fe2+、NH
、Fe2+、NH![]() 、H+和H2O,下列叙述正确的是( )
、H+和H2O,下列叙述正确的是( )
A.该反应说明Fe(NO3)2溶液不宜加酸酸化
B.该反应中氧化剂与还原剂物质的量之比为8∶1
C.若有1 mol NO![]() 发生氧化反应,则转移电子5 mol
发生氧化反应,则转移电子5 mol
D.若将该反应设计成原电池,则负极反应为Fe3++e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A. 单位时间内生成n mol A2的同时生成n mol AB
B. 容器内的总压强不随时间的变化而变化
C. 单位时间内生成2n mol AB的同时生成n mol B2
D. 单位时间内生成n mol A2的同时生成n mol B2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】J、L、M、R、T是原子序数依次增大的短周期元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
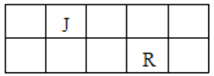
(1)M的离子结构示意图为_______________;元素T在周期表中位于第_________族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______________。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____________________。
(4)L的最简单气态氢化物甲的水溶液显碱性。
在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______________________________________。
(5)由J、R形成的液态化合物JR2 0.2 mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215 kJ。该反应的热化学方程式为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关常温下pH均为3的醋酸和硫酸的说法正确的是( )
A.两种溶液中,由水电离出的氢离子浓度均为1×10﹣11 molL﹣1
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO﹣)和硫酸中的c(SO42﹣)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图像能直观地反映有关物理量的变化及规律,下列各图像与描述相符的是
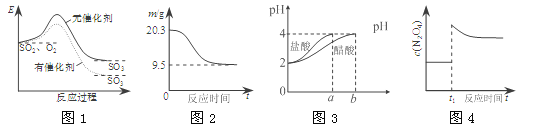
A.图1表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1 mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
C.图3表示分别稀释10 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100
D.图4表示平衡2NO2(g)![]() N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)及其化合物在生产、医疗、科技等方面有许多应用
(1)中国自古“信口雌黄”、“雄黄入药”之说。雄黄As2S3和雌黄As4S4都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。一定条件下,雌黄和雄黄的转化关系如图所示。
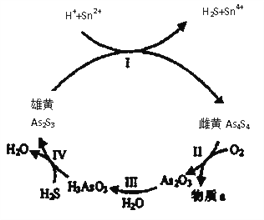
①雌黄和雄黄中S元素均为-2,I中发生的离子方程式是__________。
②Ⅱ中,雌黄在空气中加热至300℃时会产生两种物质,若4.28g As4S4反应转移0.28mole-,则a为__________(填化学式);砒霜(As2O3)可水将氧化成H3AsO4而除去,该反应的化学方程式为:__________。
(2)AsH3是一种很强的还原剂,室温下, 0.4mol AsH3气体在空气中自燃,氧化产物为As2O3固体,放出b kJ 热量,AsH3自燃的热化学方程式是:__________。
(3)将Na3AsO3(aq)+I2(aq)+H2O(l)![]() Na2HAsO4(aq)+NaI (aq)设计成原电池如图所示,放电时电流强度(I)与时间关系如图所示.
Na2HAsO4(aq)+NaI (aq)设计成原电池如图所示,放电时电流强度(I)与时间关系如图所示.
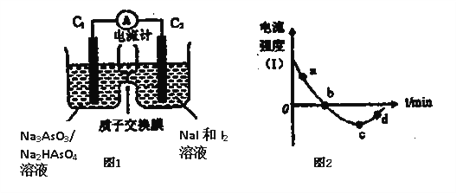
①如图中表示在该时刻上述可逆反应达到平衡状态的点是__________(填字母)。
②已知:a点对应如图中电流由C1极经外电路流向C2极。则d点对应的负极的反应式为__________。
③如图中,b→c改变条件可能是__________(填代号)。
A.向左室中加入适量的浓Na3AsO3溶液 B.向左室中加入适量的烧碱溶液
C.向右室中加入适量的浓KI溶液 D. 向右室中加入适量的稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取含Cr2O72-的模拟水样若干份,在不同pH条件下,分别向每个水样中加一定量的FeSO4或NaHSO3固体,充分反应后再滴加碱液生成Cr(OH)3沉淀,从而测定除铬率,实验结果如图所示。下列说法正确的是
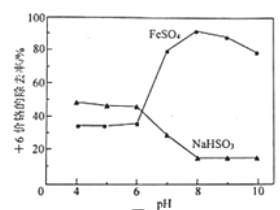
A. 理论上FeSO4的除铬率比等质量的NaHSO3高
B. 用NaHSO3除铬时,pH越低,越有利于提高除铬率
C. pH>8,FeSO4的除铬率下降与废水中溶解氧参与反应有关
D. 从提高除铬率的角度分析,处理酸性含铬废水应选用NaHSO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com