
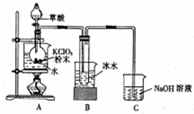
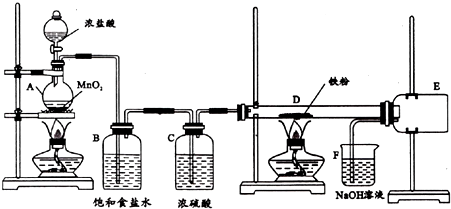
 二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:
二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:分析 在60℃时利用氯酸钾与草酸(中强酸)反应制备二氧化氯,并同时生成K2CO3和CO2等,为有效控制温度可使用水浴加热的方式,根据二氧化氯的沸点为11.0℃,易液化,可选择B装置冷却降温收集ClO2,考虑到ClO2极易爆炸,制取和使用二氧化氯时要用性质确定的气体如氮气稀释,以防爆炸,并利用NaOH吸收含ClO2的尾气,防止环境污染,
(1)装置A中氯酸钾与草酸(中强酸)反应得到二氧化氯,并同时生成K2CO3和CO2等,可根据质量守恒和原子守恒书写方程式;反应需要控制温度为60℃,测定仪器为温度计;
(2)装置B用冰水浴的目的是降温,使ClO2液化,防止气态ClO2爆炸;
(3)用NaOH吸收含有ClO2的尾气,产生之一为NaClO2,可见发生了氧化还原反应,可结合电子守恒和原子守恒判断产物;
(4)根据NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,在温度高于38℃时析出的晶体是NaClO2,故从NaClO2溶液中制得NaClO2•3H2O需要在低温下进行,可选择减压蒸发并低温冷却结晶,最后过滤、洗涤、干燥得到NaClO2•3H2O;
(5)盐酸或双氧水均能还原氯酸钠制备ClO2,但H2O2的氧化产物为O2,而盐酸的氧化产物为氯气,对环境有污染.
解答 解:(1)装置A中氯酸钾与草酸(中强酸)反应制备二氧化氯,发生反应的化学方程式为2ClO3-+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$CO32-+CO2↑+2ClO2↑+H2O;可利用温度计测定水浴温度,达到控制温度为60℃的目的,
故答案为:2ClO3-+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$CO32-+CO2↑+2ClO2↑+H2O;温度计;控制水浴加热温度为60℃;
(2)保用装置B的目的是为防止气态ClO2爆炸,利用冰水浴降温,使ClO2液化,
故答案为:常温下二氧化氯为气态,用冰水将其冷凝为液态,以防爆炸;
(3)用NaOH吸收ClO2,产物NaClO2为还原产物,根据氧化还原反应的本质,另一产物为氧化产物,NaClO2中氯为+3,从+4到+3降1价,则氧化产物从+4升高一价为+5价,此时得到的二种产物才等物质的量,也满足电子守恒,即所得产物为NaClO3,
故答案为:NaClO3;
(4)防止析出的晶体是NaClO2,采用减压蒸发并低温冷却结晶,最后过滤、洗涤、干燥得到NaClO2•3H2O,
故答案为:(减压)蒸发浓缩;低于38℃时冷却结晶;
(5)H2O2的氧化产物为O2,盐酸的氧化产物为氯气,对环境有污染,则选择用H2O2制备的ClO2比用盐酸制备的ClO2更适合用于饮用水的消毒,
故答案为:H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2.
点评 本题是物质制备实验探究分析,为高考常见题型和高频考点,题目考查制备原理分析、混合物的分离提纯、实验条件选择等,属基础考查,对提高学生分析问题解决问题的能力有促进作用,难度适中.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu+2HCl═CuCl2+H2↑ | B. | Al2O3+3H2O═2Al(OH)3 | ||
| C. | Mg(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ MgO+H2O | D. | Ba(OH)2+SO2═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
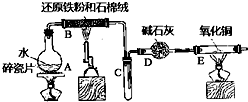 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题:
某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/(g•cm-3) | 0.789 3 | 1.460 4 | 0.809 8 | 1.275 8 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
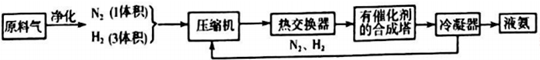
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
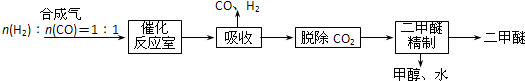
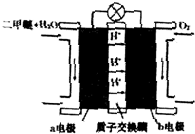
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com