
(14分)某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1mol/L(此数值忽略水的电离及离子的水解)。
阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
阴离子 | Cl- CO32- NO3- SO42- SiO32- I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是 。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是 。
(3)甲同学最终确定原溶液中所含阳离子有 ,阴离子有 ;并据此推测原溶液应该呈 性,原因是 (请用离子方程式说明)。
(4)在100mlHNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大(反应前后溶液体积变化忽略不计),则H2SO4和HNO3两种酸的物质的量浓度之比为 。
(14分,每空2分)(1)K+ 、NH4+ Cu2+
(2)6I-+2NO3-+8H+=3I2+2NO↑+4H2O
(3)Mg2+, Al3+ ; Cl-, SO42-, NO3-, I- 酸性
Mg2++2H2O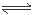 Mg(OH)2+2H+ Al3++3H2O
Mg(OH)2+2H+ Al3++3H2O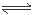 Al(OH)3+3H+
Al(OH)3+3H+
(4)3:2
【解析】
试题分析:(1)Ⅰ、取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。由于Cu2+的水溶液是蓝色的,在无色溶液中不能大量存在Cu2+;还可能含有Ag+ 、Mg2+、Al3+中至少一种离子;而且溶液中无NH4+存在;Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。说明无K+;因此根据I、Ⅱ判断,溶液中一定不含有的阳离子是K+ 、NH4+ Cu2+ ;(2)Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。说明溶液中含有NO3-及还原性微粒I-;由于元素大量产生的离子会和Ag+、SiO32-发生沉淀反应形成AgCl沉淀、H2SiO3沉淀,因此无Ag+、SiO32-;二者发生氧化还原反应产生NO;NO与O2反应产生NO2;反应的离子方程式是:6I-+2NO3-+8H+=3I2+2NO↑+4H2O;Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成,证明含有SO42-;由于原溶液中各种离子的浓度都是0.1mol/L,而且溶液应该呈电中性,所以阳离子为Mg2+, Al3+; 阴离子是Cl-, SO42-, NO3-;I-;由于酸都是强酸,而金属阳离子都是弱碱的金属阳离子,金属阳离子方程式水解反应消耗水电离产生的OH-,破坏了水的电离平衡,当最终达到平衡时,溶液中c(H+)>c(OH-)原溶液应该呈酸性,原因用离子方程式是Mg2++2H2O Mg(OH)2+2H+ ; Al3++3H2O
Mg(OH)2+2H+ ; Al3++3H2O Al(OH)3+3H+。(4)Cu与稀硝酸反应的离子方程式是:3Cu+8H++2NO3-=3Cu2++2NO↑+H2O;若使溶液中Cu2+的物质的量浓度最大,则n(H+):n(NO3-)=8:2,则n(H2SO4):n(HNO3)=[(8-2)÷2]:2=3:2。
Al(OH)3+3H+。(4)Cu与稀硝酸反应的离子方程式是:3Cu+8H++2NO3-=3Cu2++2NO↑+H2O;若使溶液中Cu2+的物质的量浓度最大,则n(H+):n(NO3-)=8:2,则n(H2SO4):n(HNO3)=[(8-2)÷2]:2=3:2。
考点:考查守恒方法在溶液成分的确定的应用、离子存在的鉴定、混合溶液的计算的知识。


科目:高中化学 来源:2014-2015学年山东省菏泽市高三上学期期末考试化学B试卷(解析版) 题型:选择题
I2在KI溶液中存在下列平衡:I2(aq)+ I-(aq) I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是

A.反应 I2(aq)+ I-(aq) I3-(aq) 的ΔH<0
B.若反应进行到状态D时,反应速率一定有V(正)﹥V(逆)
C.状态A与状态B相比,状态A的c(I2)大
D.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
某有机物的结构简式如图所示,下列有关该物质的叙述错误的是
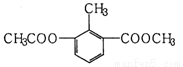
A.分子式为C11H12O4
B.苯环上的一氯代物有2种
C.分子中所有的碳原子可能共平面
D.能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校高三下学期3月模拟考试理综化学试卷(解析版) 题型:实验题
(14分)过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:

已知:主反应:2Na2CO3 (aq) + 3H2O2 (aq)  2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
副反应:2H2O2 = 2H2O + O2↑
50℃时2Na2CO3·3H2O2 (s) 开始分解

请回答下列问题:
(1)步骤①的关键是控制温度,原因是 ,其措施有_______、_________和_________。
(2)在滤液X中加入适量NaCl固体可析出过碳酸钠,原因是_________________。
(3)步骤③中选用无水乙醇洗涤产品的目的是 。
(4)下列物质中,会引起过碳酸钠失效的有 。
A.NaHCO3 B.MnO2 C.Na2SiO3 D.Na2SO3
(5)过碳酸钠产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取样品溶解→加入BaCl2溶液→过滤→洗涤→干燥→称量。需要直接测定的物理量有: 样品的质量m1g、沉淀的质量m2g(用字母表示并注明其含义)。产品中过碳酸钠质量分数的表达式为: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校高三下学期3月模拟考试理综化学试卷(解析版) 题型:选择题
下图为雾霾的主要成分示意图。下列说法不正确的是
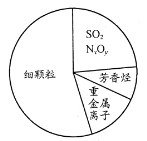
A.重金属离子可导致蛋白质变性
B.苯是最简单的芳香烃
C.SO2和NxOy都属于酸性氧化物
D.汽车尾气的大量排放是造成雾霾天气的人为因素之一
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省仙桃天门潜江高三上学期期末联考理综化学试卷(解析版) 题型:选择题
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中正确的是

A.将熔融CaF2—CaO换成Ca(NO3)2溶液也可以达到相同目的
B.阳极的电极反应式为:C+2O2--4e-=CO2↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省八市高三年级三月联考理综化学试卷(解析版) 题型:填空题
(13分)研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知拆开1 mol H2、1 mol O2和液态水中1 mol O—H键使之成为气态原子所需的能量分别为436 kJ、496 kJ和462 kJ;CH3OH(g)的燃烧热为627 kJ·mol-1。则CO2(g)+3H2(g)=CH3OH(g)+H2O(l) H= kJ·mol-1。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
①该反应平衡常数表达式K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的H 0(填“>”或“<”)。若温度不变,减小反应投料比[n(H2)/n(CO2)],则K将 (填“增大”、“减小”或“不变”)。

③某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,当下列物理量不再发生变化时,能表明上述可逆反应达到化学平衡的是 。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(3)向澄清的石灰水中通入CO2至溶液中的Ca2+刚好完全沉淀时,则溶液中c(CO32-)= 。[已知:Ksp(CaCO3)=2.8×10-9]
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高一上学期期末考试化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4LSO3含有NA个分子
B.标准状况下,22.4LCO2与CO的混合气体含NA个分子
C.1molNa2O2与足量CO2反应转移的电子数为NA
D.常温下NA个H2分子的质量约为2g,它所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末考试化学试卷(解析版) 题型:选择题
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是

A.Mg2+、Al3+、Fe2+ B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com