
锶(Sr)为第五周期第II A族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,用工业碳酸锶粉末(含少量钡、铁的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。
已知:SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。请回答:
(1)操作①加快反应速率的措施有 (任写一种方法)。碳酸锶与盐酸反应的离子方程式为 。
(2)加入少量30% H2O2溶液的发生反应的离子方程式为 。
(3)步骤③中调节溶液pH至8—10,宜选用的试剂为_______(填序号):
A.氨水 B.氢氧化钠 C. 氢氧化锶粉末 D.碳酸钠晶体
所得滤渣的主要成分是Fe(OH)3和 (填化学式)。
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是 。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(5)若滤液中Ba2+ 浓度为1×10-5mol/L,依下表数据推算出滤液中Sr2+物质的量浓度不大于 mol/L。
| | SrSO4 | BaSO4 | Sr(OH)2 |
| Ksp | 3.3×10—7 | 1.1×10—10 | 3.2×10—4 |
(16分)
(1)(共5分)升高温度、或增大盐酸浓度、或充分搅拌等(合理均可,2分)
SrCO3+2H+=Sr2++CO2↑+H2O (3分)
(2)(共3分)2Fe2++H2O2+2H+=2Fe3++2H2O
(3)(共4分)C(2分) BaSO4(2分)
(4)(共2分) A
(5)(共2分)0.03(或3×10-2)
[计算过程:c(SO42-)=1.1×10-10÷10-5 mol?L-1=1.1×10-5 mol?L-1,c(Sr2+)=3.3×10-7÷1.1×10-5 mol?L-1=3×10-2 mol?L-1]
解析试题分析:(1)根据影响化学反应速率的因素,升高温度、或增大盐酸浓度、或充分搅拌等都能加快反应速率;盐酸的酸性比碳酸强,因此碳酸锶与盐酸能发生复分解反应,同主族元素具有相似性,镁、钙、锶、钡都是第IIA族,碳酸镁微溶、碳酸钙难溶、碳酸钡难溶,由此推断碳酸锶难溶于水,应保留化学式,则该反应为SrCO3+2H+=Sr2++CO2↑+H2O;
(2)铁的化合物溶于盐酸时可能生成亚铁离子和铁离子,双氧水具有强氧化性,是绿色氧化剂,可以将亚铁离子氧化为铁离子,即2Fe2++H2O2+2H+=2Fe3++H2O,便于除铁;
(3)氨水与氢离子容易结合成铵根离子,虽然能消耗氢离子,升高溶液的pH,但是引入的铵根离子是新的杂质,故A选项错误;氢氧化钠也能消耗氢离子,达到调节溶液pH的目的,但是引入的钠离子是新的杂质,故B选项错误;氢氧化锶能消耗氢离子,将溶液pH调至8~10,且引入的锶离子是目标产物需要的离子,故C选项正确;碳酸钠能消耗氢离子,但是会引入钠离子,故D选项错误;由于钡的化合物溶于盐酸产生钡离子,加入过量硫酸时,硫酸根离子与钡离子结合生成硫酸钡沉淀,则滤渣的主要成分是氢氧化铁和硫酸钡;
(4)由于SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水,为了减少目标产物的损失,不能使温度达到61℃或61℃以上,故只有A选项正确;
(5)由于BaSO4(s) Ba2++SO42—,Ksp(BaSO4)=c(Ba2+)?c(SO42—),则滤液中c(SO42—)= 1.1×10—10÷1×10-5 mol/L =1.1×10—5mol/L,由于SrSO4(s)
Ba2++SO42—,Ksp(BaSO4)=c(Ba2+)?c(SO42—),则滤液中c(SO42—)= 1.1×10—10÷1×10-5 mol/L =1.1×10—5mol/L,由于SrSO4(s) Ba2++SO42—,为了防止锶离子沉淀,则Qc(SrSO4)=c(Sr2+)?c(SO42—)≤Ksp(SrSO4),则滤液中c(Sr2+)≤3.3×10—7÷1.1×10-5 mol/L =3.0×10—2mol/L。
Ba2++SO42—,为了防止锶离子沉淀,则Qc(SrSO4)=c(Sr2+)?c(SO42—)≤Ksp(SrSO4),则滤液中c(Sr2+)≤3.3×10—7÷1.1×10-5 mol/L =3.0×10—2mol/L。
考点:考查物质制备化学工艺流程,涉及加快酸浸反应速率的措施、盐酸与碳酸锶反应的离子方程式、加入过氧化氢时反应的离子方程式、选择合理的试剂调节溶液pH除杂、滤渣的成分、选择合适的烘干温度、硫酸钡和硫酸锶溶度积的计算等。


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:填空题
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如图所示(图中某些转化步骤及生成物未列出):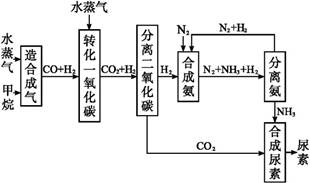
请填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量。该反应的热化学方程式是 。
(2)上述流程中,工业上分离H2、CO2合理的方法是 。
| A.混合气先通入氢氧化钠溶液,再在溶液中加入盐酸 |
| B.混合气加压冷却,使CO2液化 |
| C.混合气用氨水洗涤 |
| D.混合气先通入石灰浆中,然后高温煅烧固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。钨在自然界主要以钨(+6价)酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。白钨矿的主要成分是钨酸钙(CaWO4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe.Mn)WO4。黑钨矿传统冶炼工艺的第一阶段是碱熔法: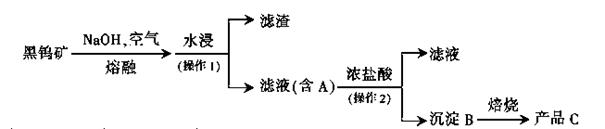
其中A、B、C都是钨的化合物。回答:
(1)碱熔时,钨酸亚铁转化为氧化铁和钨酸钠,写出相应反应的化学方程式____。
(2)操作2的名称是 ,实验室中证明沉淀B是否洗净的方法是 ;实验室中焙烧需要的主要仪器有____;
(3)写出用氢气还原氧化钨制取金属钨的化学方程式; ;为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂,因为____。
(4)某种蓝色氧化钨的化学式可以表示为WO2.8,一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价两种价态的钨。则蓝色氧化钨中这五价钨与六价钨的原子数目之比为 :_ ___。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示: 
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
(1)化合物FeTiO3中铁元素的化合价是 。
(2)滤渣A的成分是 。
(3)滤液B中TiOCl42- 转化生成TiO2的离子方程式是 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如下图所示。反应温度过高时,Ti元素浸出率下降的原因是 。
(5)反应③的化学方程式是 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是 。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12+3LiFePO4 Li7Ti5O12+3FePO4
Li7Ti5O12+3FePO4
该电池充电时阳极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(己知Cd的金属活动性介于Zn和Fe之间)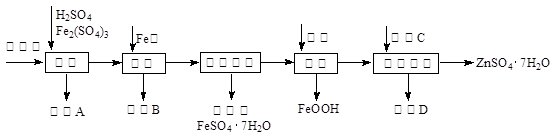
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 ,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子是Cd2+,所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学工业是国民经济的支柱产业,下列生产过程中不涉及化学变化的是
| A.氮肥厂用氢气和氮气合成氨 | B.钢铁厂用热还原法冶炼铁 |
| C.工业上常用接触法生产硫酸 | D.炼油厂用分馏法生产汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是( )
| A.硫铁矿煅烧前将要矿粒粉碎,因为大块的硫铁矿不能燃烧 |
| B.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应 |
| C.SO2氧化为SO3时需使用催化剂,这样可以提高SO2的转化率 |
| D.SO3用质量分数为98%的浓H2SO4吸收,目的是防止形成酸雾,以便使SO3吸收完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列工业生产中,各物质的物质的量间的关系式不正确的是( )
| A.制漂白粉:2Cl2~Ca(ClO)2 |
| B.制H2SO4:FeS2~2H2SO4 |
| C.合成氨:C~H2~2/3NH3 |
| D.制HNO3:NH3~HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )。
2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )。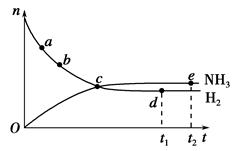
| A.点a的正反应速率比点b的小 |
| B.点c处反应达到平衡 |
| C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com