
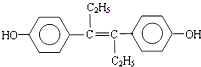
 乙烯雌酚是一种激素类药物,结构简式如图.
乙烯雌酚是一种激素类药物,结构简式如图.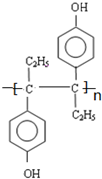 .
. 分析 (1)该分子中含氧官能团是酚羟基;
(2)碳碳双键和苯环都能和氢气发生加成反应;
(3)该分子中含有酚羟基和碳碳双键,具有酚和烯烃性质;
(4)含有碳碳双键,所以能发生加聚反应生成高分子化合物.
解答 解:(1)根据结构简式知,该分子中含氧官能团是羟基,故答案为:羟基;
(2)碳碳双键和苯环都能和氢气发生加成反应,1mol乙烯雌酚最多能与7mol H2发生加成反应,
故答案为:7;
(3)①含有酚羟基,所以具有弱酸性,故正确;
②根据结构简式知,其分子式为 C18H20O2,故正确;
③不含羧基,所以不能与碳酸钠溶液反应放出二氧化碳,故错误;
故选①②;
(4)含有碳碳双键,所以在一定条件下能发生加聚反应生成高分子化合物,结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物结构和性质,明确官能团及其性质关系是解本题关键,侧重考查酚、烯烃性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
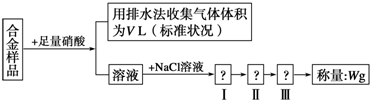
| A. | 合金的熔点比其成分金属低,通常比成分金属具有更优良的金属特性 | |
| B. | 铜银都能与稀硝酸反应,收集到的V L气体可能全为NO | |
| C. | 操作Ⅰ是过滤,操作Ⅱ是洗涤,操作Ⅲ应是烘干 | |
| D. | 根据反应收集到的气体体积可以计算铜和银的质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为可逆反应,故在一定条件下SO2和O2不可能全部转化为SO3 | |
| B. | 达到平衡后,反应就停止了,故正、逆反应速率相等且均为零 | |
| C. | 一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻之后,正、逆反应速率相等 | |
| D. | 平衡时SO2、O2、SO3的分子数之比不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
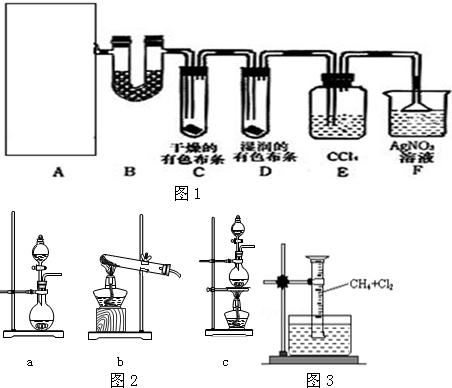
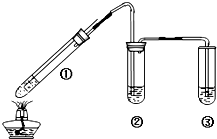 某小组用图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.
某小组用图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
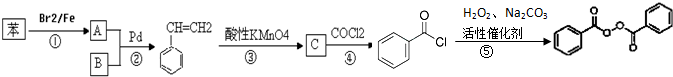
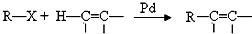
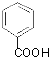 ;
;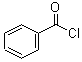 +H2O2$→_{碳酸钠}^{催化剂}$
+H2O2$→_{碳酸钠}^{催化剂}$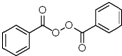 +2HCl;
+2HCl;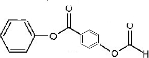 或
或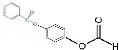 ;
; 的流程,无机物任选,注明反应条件.
的流程,无机物任选,注明反应条件.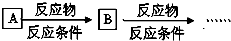
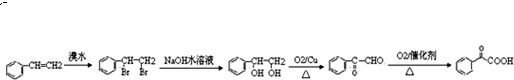 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有达到平衡时,消耗O2的速率与生成NO的速率之比才为5;4 | |
| B. | 若单位时间生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态 | |
| C. | 达到平衡状态后,NH3、O2、NO、H2O(g)的物质的量保持不变 | |
| D. | 达到平衡状态时,若增加容器体积,则反应速率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com