
| C(H+) |
| C(OH-) |
| 10-14 |
| c(H+) |
| Kw |
| c(H+) |
| 10-14 |
| 10-a |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 103a-42 |
| 2 |
| c(H+) |
| c(OH-) |
| c(H+) |
| c(OH-) |
| ||
| V1+V2 |
| 10-12 |
| 10-7 |


科目:高中化学 来源: 题型:
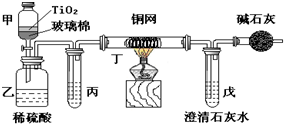 未来生活中金属钛的运用越来越广泛,如可在催化剂TiO2作用下,先用NaClO将CN-(毒性很强)氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用如图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题:
未来生活中金属钛的运用越来越广泛,如可在催化剂TiO2作用下,先用NaClO将CN-(毒性很强)氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用如图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B、取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+ |
| C、取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D、取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| CuO |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
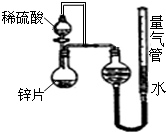 某同学设计了如图所示的装置(夹持装置已略去),来探究影响化学反应速率的因素.
某同学设计了如图所示的装置(夹持装置已略去),来探究影响化学反应速率的因素.| 序号 | Ⅴ(H2SO4)/mL | C(H2SO4)/mol?L-1 | t/s |
| Ⅰ | 10 | 1 | t1 |
| Ⅱ | 10 | 3 | t2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com