

 ,H2O的结构式为H-O-H,故答案为:
,H2O的结构式为H-O-H,故答案为: ;H-O-H;
;H-O-H;
| ||
| ||


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
| ||
| A、1:2 | B、2:1 |
| C、1:1 | D、3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠溶液吸收过量的二氧化碳 OH-+CO2=HCO3- |
| B、亚硫酸氢铵溶液与足量氢氧化钠溶液反应 HSO3-+OH-=SO32-+H2O |
| C、氯气通入冷水中 Cl2+H2O=Cl-+ClO-+2H+ |
| D、碳酸镁悬浊液中加醋酸 CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g?L-1.某兴趣小组用右图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.(可能用到的相对原子质量:H-1 O-16 S-32)
中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g?L-1.某兴趣小组用右图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.(可能用到的相对原子质量:H-1 O-16 S-32)查看答案和解析>>
科目:高中化学 来源: 题型:
| NaCN |
| HCl |
| 水解 |
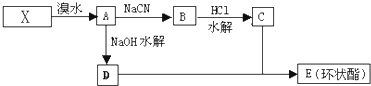
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
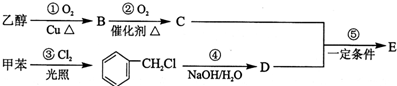
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电解 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com