
| A、H2、D2、T2互为同位素 |
| B、金属氧化物均为碱性氧化物 |
| C、质量数为131,中子数为78的碘原子常用于核反应堆的燃料棒.其核外电子数为53 |
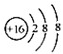
D、S2-的结构示意图: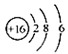 |
 ,故D错误;
,故D错误;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、①②③④⑥ |
| B、④⑤⑥⑦⑧ |
| C、③④⑤⑥⑦ |
| D、②③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②①③④ | B、①③④② |
| C、①④③② | D、②③④① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、75 mL 2 mol/L的CaCl2 |
| B、150 mL 3 mol/L的KCl |
| C、150 mL 1 mol/L的NaCl |
| D、75mL 2 mol/L的NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸溶液中加入氢氧化钡溶液 Ba2++SO42-=BaSO4↓ |
| B、钠与水反应 Na+2H2O=Na++2OH-+H2↑ |
| C、碳酸钠溶液中加入足量盐酸 CO32-+2H+=CO2↑+H2O |
| D、铝片与硝酸汞溶液反应 Al+Hg2+=Al 3++Hg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+184.6kJ?mol-1 |
| B、-92.3kJ?mol-1 |
| C、-369.2kJ?mol-1 |
| D、+92.3kJ?mol- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的最高化合价为+4 |
| B、X是第三周期VA族元素 |
| C、X是第三周ⅥA族元素 |
| D、X的最高价含氧酸的分子式可表示为H2XO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com