
某有机物链状分子中含a个甲基,n个亚甲基(﹣CH2﹣),m个次甲基(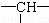 ),其余为羟基.则羟基的个数为( )
),其余为羟基.则羟基的个数为( )
|
| A. | 2n+3m﹣a | B. | n+m+a | C. | m+2﹣a | D. | m+2n+2﹣a |
考点:
有机化合物中碳的成键特征.
专题:
有机物分子组成通式的应用规律.
分析:
有机物主要靠C原子连接,每个碳原子都必须形成4个共价键,以1条碳链分析考虑,先分析若只连接甲基,计算连接的甲基数目,再根据分子中含有的甲基数目计算羟基数.1个﹣CH﹣可连接1个甲基,﹣CH2﹣不管多少个只能连接两个﹣CH3.据此计算判断.
解答:
解:若只连接甲基,﹣CH2﹣不管多少个只能连接两个﹣CH3,m个﹣CH﹣,能连接m个﹣CH3,所以n个﹣CH2﹣,m个﹣CH﹣,连接﹣CH3共计m+2个.由于分子中含有a个﹣CH3,所以连接的﹣OH为m+2﹣a.
故选C.
点评:
本题考查有机化合物中成键特征,难度中等,关键清楚有机物主要靠C原子连接,每个碳原子都必须形成4个共价键.


科目:高中化学 来源: 题型:
下列叙述中正确的是( )
|
| A. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 |
|
| B. | 元素由化合态变为游离态的反应一定是还原反应 |
|
| C. | 置换反应一定是氧化还原反应 |
|
| D. | 失电子难的原子,一定容易得电子,反之成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列物质:①乙醇;②苯酚;③乙醛;④丙烯酸(CH2=CHCOOH);⑤乙酸乙酯.其中与溴水、KMnO4酸性溶液、NaHCO3溶液都能反应的是( )
|
| A. | 仅①③ | B. | 仅②⑤ | C. | 仅④ | D. | 仅③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
小红在帮实验员整理化学试剂时,发现一瓶标签破损的无色溶液,标签严重破损,只能隐约看到一部分(如图).下列说法不正确的是( )

|
| A. | 该有机物肯定是甲酸乙酯,能发生银镜反应 |
|
| B. | 该有机物的分子式为C3H6O2 |
|
| C. | 在酸性条件下水解生成两种有机产物的相对分子质量可能相等 |
|
| D. | 在碱性条件下可完全水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求完成下列问题:
①某高分子有机物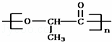 是由一种单体缩聚而成的,该单体的键线式为
是由一种单体缩聚而成的,该单体的键线式为
②将少量水杨酸(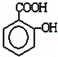 )滴入少量Na2CO3溶液中发生的化学方程式:
)滴入少量Na2CO3溶液中发生的化学方程式:
③CH2ClCOOCH2CH3与NaOH的水溶液共热:
④有机物 在较高温度下和Br2按物质的量之比1:1发生加成反应的化学方程式 .
在较高温度下和Br2按物质的量之比1:1发生加成反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列给出14种元素的电负性:
元素 Al B Be C Cl F Li Mg N Na O P S Si
电负性 1.5 2.0 1.5 2.5 3.0 4.0 1.0 1.2 3. 0 0.9 3.5 2.1 2.5 1.8
请运用元素周期律知识完成下列各题.
(1)同一周期中,从左到右,元素的电负性逐渐 ;同一主族中,从上到下,元素的电负性逐渐 .所以,元素的电负性随原子序数的递增呈 变化.
(2)短周期元素中,由电负性最大的元素与电负性最小的元素形成的化合物的化学式为NaF,用电子式表示该化合物的形成过程: .
(3)表中符合“对角线规则”的元素有Li和 、Be和 、B和 ,它们的性质分别有一定的相似性,其原因是 ,写出Be(OH)2与强酸及强碱反应的离子方程式: .
(4)一般认为,两成键元素间电负性差值大于1.7时形成离子键,两成键元素间电负性差值小于1.7时,形成共价键.判断Mg3N2、SO2、AlCl3、CS2、MgO是离子化合物还是共价化合物.
离子化合物 、共价化合物 .
查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液中能大量共存的一组离子是( )
A. NH4+、Ba2+、Br﹣、CO32﹣ B. Cl﹣、SO32﹣、Fe2+、H+
C. K+、Na+、SO42﹣、MnO4﹣ D. Na+、H+、NO3﹣、HCO3﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com