
【题目】实验小组探究铝片做电极材料时的原电池反应,设计下表中装置进行实验并记录。
【实验1】
装置 | 实验现象 |
| 左侧装置电流计指针向右偏转,灯泡亮 右侧装置电流计指针向右偏转,镁条、铝条表面产生无色气泡 |
(1)实验1中,电解质溶液为盐酸,镁条做原电池的________极。
【实验2】
将实验1中的电解质溶液换为NaOH溶液进行实验2。
(2)该小组同学认为,此时原电池的总反应为2Al + 2NaOH + 2H2O ![]() 2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
实验2实际获得的现象如下:
装置 | 实验现象 |
| i.电流计指针迅速向右偏转,镁条表面无气泡,铝条表面有气泡 ⅱ.电流计指针逐渐向零刻度恢复,经零刻度后继续向左偏转。镁条表面开始时无明显现象,一段时间后有少量气泡逸出,铝条表面持续有气泡逸出 |
(3)i中铝条表面放电的物质是溶解在溶液中的O2,则该电极反应式为________。
(4)ii中“电流计指针逐渐向零刻度恢复”的原因是________。
【实验3和实验4】
为了排除Mg条的干扰,同学们重新设计装置并进行实验3和实验4,获得的实验现象如下:
编号 | 装置 | 实验现象 |
实验3 |
| 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约10分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
实验4 |
煮沸冷却后的溶液 | 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
(5)根据实验3和实验4可获得的正确推论是________ (填字母序号)。
A. 上述两装置中,开始时铜片表面得电子的物质是O2
B. 铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关
C. 铜片表面产生的气泡为H2
D. 由“铝条表面气泡略有减少”能推测H+在铜片表面得电子
(6)由实验1~实验4可推知,铝片做电极材料时的原电池反应与________等因素有关。
【答案】 负 指针向左偏转,镁条表面产生无色气泡 O2 + 2H2O + 4e- ![]() 4OH- Mg放电后生成Mg(OH)2附着在镁条表面,使Mg的放电反应难以发生,导致指针归零;或:随着反应的进行,铝条周围溶液中溶解的O2逐渐减少,使O2放电的反应难以发生,导致指针归零 ABC 另一个电极的电极材料、溶液的酸碱性、溶液中溶解的O2
4OH- Mg放电后生成Mg(OH)2附着在镁条表面,使Mg的放电反应难以发生,导致指针归零;或:随着反应的进行,铝条周围溶液中溶解的O2逐渐减少,使O2放电的反应难以发生,导致指针归零 ABC 另一个电极的电极材料、溶液的酸碱性、溶液中溶解的O2
【解析】(1). Mg的活泼性大于Al,当电解质溶液为盐酸时,Mg为原电池的负极,故答案为:负;
(2). 原电池的总反应为2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑,由反应方程式可知,Al为原电池的负极,Mg为原电池的正极,镁条表面产生无色气泡,再结合实验1的现象可知,电流计指针由负极指向正极,则实验2中的电流计指针向左偏转,故答案为:指针向左偏转,镁条表面产生无色气泡;
(3). i中铝条表面放电的物质是溶解在溶液中的O2,在碱性溶液中,氧气发生的电极反应式为:O2 + 2H2O + 4e- = 4OH-,故答案为:O2 + 2H2O + 4e- = 4OH-;
(4). 因Mg放电后生成的Mg(OH)2附着在镁条表面,使Mg的放电反应难以发生,导致指针归零,同时随着反应的进行,铝条周围溶液中溶解的O2逐渐减少,使O2的放电反应也难以发生,导致指针归零,故答案为:Mg放电后生成Mg(OH)2附着在镁条表面,使Mg的放电反应难以发生,导致指针归零,或随着反应的进行,铝条周围溶液中溶解的O2逐渐减少,使O2放电的反应难以发生,导致指针归零;
(5). 根据实验3和实验4的实验现象可知,电流计指针向左偏转,说明铜为正极,A. 上述两装置中,开始时溶液中溶解的O2在铜片表面得电子,导致开始时铜片没有明显现象,故A正确;B. 因开始时溶液中溶解的O2在铜片表面得电子,所以铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关,故B正确;C. 当溶液中溶解的氧气反应完后,氢离子在铜片表面得到电子,产生的气泡为H2,故C正确;D. 因铝条表面始终有气泡产生,则气泡略有减少不能推测H+在铜片表面得电子,故D错误;答案选ABC;
(6). 由实验1~实验4可推知,铝片做电极材料时的原电池反应与另一个电极的电极材料、溶液的酸碱性、溶液中溶解O2的多少等因素有关,故答案为:另一个电极的电极材料、溶液的酸碱性、溶液中溶解的O2。


科目:高中化学 来源: 题型:
【题目】下表1是常温下几种弱酸的电离常数(K),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1几种弱酸的电离常数(25℃)
酸 | 电离常数(K) |
CH3COOH | 1.8×10-5 |
HNO2 | 5.1×10-4 |
HCN | 6.2×10-10 |
HClO | 3×10-8 |
表2几种难溶电解质的溶度积(25℃)
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1.1×10-10 |
MgCO3 | 6.8×10-6 |
CaSO4 | 9.1×10-6 |
CaCO3 | 2.8×10-9 |
请回答下列问题:
(1)表1四种酸中,酸性最强的是____________(用化学式表示)。会使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是__________。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)常温下,相同物质的量浓度的表1中4种酸的钠盐pH由大到小的顺序是______________________________ (填钠盐的化学式)。若将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液中各离子浓度由大到小的排列顺序是______________________________。
(3)①根据表2四种难(微)溶物的溶度积常数计算BaSO4的溶解度_______________(单位用g/L)表示,(已知![]() )。
)。
②在含有100mL0.2mol/L Ba2+、Ca2+、Mg2+的混合溶液中加入100mL0.1mol/LNa2SO/span>4溶液,反应后溶液中生成的沉淀是_________,此时SO42-的浓度是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学研究的正确说法是( )
A. 同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B. 从HF、HCl、HBr、HI酸性递增的事实,推出F、、Cl、Br、I的非金属递增的规律
C. 利用“海水→氢氧化镁→氯化镁→金属镁”的工艺流程生产金属镁
D. 依据丁达尔现象可将分散系分为溶液、胶体与浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25 ℃时,它们的物质的量分数随pH 的变化如图所示,下列叙述错误的是
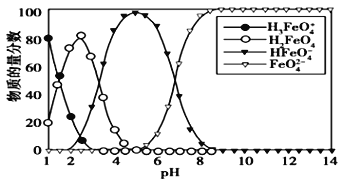
A. 向pH=5 的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pH= 4时,溶液中c(HFeO4-)/ c(H2FeO4)= 1.2
D. pH=2 时,溶液中主要含铁型体浓度的大小关系为 c(H2FeO4)> c(H3FeO4+)> c(HFeO4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:
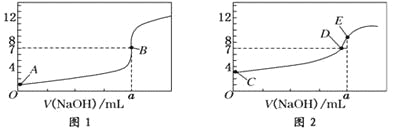
以HA表示酸,下列说法正确的是( )
A. 滴定盐酸的曲线是图2
B. 达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C. 达到B、E状态时,反应消耗的n( CH3COOH)>n(HCl)
D. 当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重水(D2O)是重要的工业原料,下列说法错误的是( )
A. H2O与D2O互称同素异形体
B. 4gD2和20g18O2的单质化合时,最多可以生成22gD218O
C. 标准状况下,氕(H)、氘(D)氘(T)对应的单质的密度之比为1:2:3
D. 1H与D互称同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A<B<C<D。②四种元素之间形成的某三种分子的比例模型及部分性质如下:
物质 | 比例模型图 | 存在或性质 |
甲 |
| 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二 |
乙 |
| 无色,无气味并且易燃。是常见的一种基础能源 |
丙 |
| 有强氧化性的弱酸,有漂白性,可用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)A的元素符号是__________;C元素在元素周期表中的位置是_______;甲的电子式是_______。
(2)丙可由D元素的单质与物质甲反应得到,该反应的离子方程式是________;D所在周期中,E元素的单质还原性最强,则E的单质与甲反应后的溶液呈_______(填“酸”或“碱”)性,用电离方程式表示其原因是___________________________。
(3)①A、B、C元素可组成多种化合物。由A、C组成的一种化合物丁,其产量常常用来衡量一个国家石油化工发展水平,则实验室中可用来除去乙中少量丁的试剂是_________。
②A、B、C组成的化合物中,有2种化合物的化学式均为C2A6B,则这2种化合物的关系互称为_________。为了鉴别这两种化合物,某同学用一小块E的单质分别投入盛有这2种化合物的试管中,其中与E的单质发生反应的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天宫二号空间实验室于2016年9月15 日在酒泉卫星发射中心发射成功。实验室承载了10余项太空实验,其中包含了好比科幻英维“综合材料”多晶碲化锌(ZnTe)的实验。
(1)电负性Zn___________Te(填“>”或“<”或“=”)。
(2)O、S、Se与Te元素位于同一主族。基态碲(Te)原子核外电子排布式为[Kr]________,有_______个未成对电子。
(3)H2O、H2S、H2Se沸点由低到高顺序为______,推断的依据是_______;SO2分子中S原子采取_____杂化;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是____________。
(4)向氯化锌溶液中加入过量的氨水,得到[Zn(NH3)4]Cl2,此配位化合物中含有的化学键有共价键、____、_______。
(5)碲化锌晶体有两种结构,其中一种晶胞结构如下图:
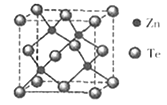
晶胞中含有_____个Te原子;与Te原子距离最近的Te原子有______个;若两个距离最近的Te原子间距为apm.则晶体密度为_________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84 g·cm-3)配制1mol·L-1的稀硫酸100mL,配制溶液时可能用到的仪器有①玻璃棒;②胶头滴管;③100mL容量瓶;④托盘天平;⑤50mL烧杯;⑥10mL量筒。则正确的选用顺序是 ( )
A.⑥③⑤①②B.⑥⑤③①②
C.④⑤③②①D.⑥⑤①③②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com