
实验室制取少量溴乙烷的装置如图所示。根据题意完成下列填空:
(1)圆底烧瓶中加入的反应物是溴化钠、 和1:1的硫酸。配制体积比1:1的硫酸所用的定量仪器为 (选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式 。
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是 。
试管A中的物质分为三层(如图所示),产物在第 层。
(4)试管A中除了产物和水之外,还可能存在 、
(写出化学式)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是 (选填编号)。
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是 。
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是: 。
(1)乙醇,b (2)NaBr+H2SO4→HBr+NaHSO4 CH3CH2OH+HBr CH3CH2Br+H2O
CH3CH2Br+H2O
(3) 冷却、液封溴乙烷;3 (4)HBr、CH3CH2OH(合理即给分)
(5) d,乙烯 (6)反应会产生Br2,腐蚀橡胶
解析试题分析:(1)制备溴乙烷需乙醇和溴化氢反应,故需要加乙醇;配制稀硫酸需要量筒来量所需浓硫酸的体积,故选b;(2)溴化钠和浓硫酸反应先制得溴化氢,溴化氢再和乙醇反应生成溴乙烷;(3)冰水将溴乙烷冷凝;(4)还可能有挥发出来的溴化氢和乙醇;(5)有机物呈棕黄色是因为溶有溴单质,有强氧化性,可以和亚硫酸钠反应而除去;氢氧化钠虽然和溴单质能反应,但和溴乙烷也发生反应,故选d;在浓硫酸做催化剂的作用下乙醇发生消去反应生成乙烯,注意名称应该写汉字;(6)考虑橡胶管换成玻璃管,原因是溴腐蚀橡胶。
考点:考查溴乙烷的制备、除杂、副反应的分析、溴单质的化学性质等知识。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:填空题
以白云石(化学式表示为MgCO3·CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示。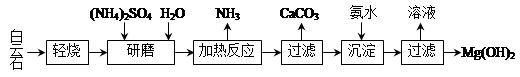
(1)研磨的作用是 。
(2)该工艺中可循环使用的物质是 、 (写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是 。
(4)加热反应的离子方程式为 。
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。
②由图可知,随着温度升高: 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。下图是以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料生产钛白粉并获得副产品FeSO4·7H2O的工艺流程图。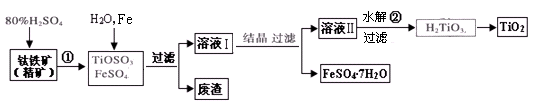
(1)钛铁矿与硫酸发生反应①的化学方程式为 ;在TiOSO4和FeSO4溶液中加入Fe的目的是 。
(2)溶液Ⅱ中TiOSO4在加热条件下发生水解反应②的离子方程式为 ;可回收利用的物质是 。
(3)为测定溶液Ⅱ中TiOSO4的含量,首先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用 (填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,当溶液出现红色达到滴定终点,用去了30.00mL FeC13溶液。待测钛液中TiOSO4的物质的量浓度是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)某化学兴趣小组用如下图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。

图1 图2
(1)写出该实验中生成乙烯的化学方程式 。
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是 。
a.乙烯与溴水易发生取代反应
b.使溴水褪色的反应,未必是加成反应
c.使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后试管中另一现象后并借用pH试纸测定,证明反应中有乙烯生成,请简述
。
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加上图2装置以除去乙醇蒸气和SO2,则A中的试剂是 ,B中的试剂为 。
(5)处理上述实验后烧瓶中废液的正确方法是 。
a.冷却后倒入下水道中 b.冷却后倒入空废液缸中 c.冷却后加水稀释,倒入废液缸中,加废碱中和
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
[实验化学]
对硝基苯甲酸在医药、感光材料等工业中应用广泛。以对硝基甲苯等为原料制取对硝基苯甲酸(黄色结晶,熔点242 ℃,沸点约359 ℃,微溶于水,能升华。)的反应原理为: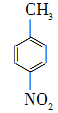 +Na2Cr2O7+4H2SO4―→
+Na2Cr2O7+4H2SO4―→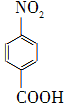 +Na2SO4+Cr2(SO4)3+5H2O
+Na2SO4+Cr2(SO4)3+5H2O
某小组以对硝基甲苯等物质为原料制取对硝基苯甲酸的实验装置如下图所示(加热和仪器固定装置均已略去),实验步骤如下:
步骤1:向250 mL三颈烧瓶中依次加入适量的对硝基甲苯、重铬酸钠粉末、水,并充分混合。在搅拌下,用滴液漏斗滴入适量浓硫酸后,加热0.5 h至反应液呈黑色。
步骤2:待反应混合物冷却后,和适量冰水充分混合,抽滤并用50 mL水分两次洗涤。将洗涤后的固体放入盛有适量5%硫酸溶液中,水浴加热10 min,冷却后抽滤。
步骤3:将抽滤后的固体溶于适量5%NaOH溶液中,50 ℃温热后抽滤,在滤液中加入少量活性炭,煮沸后趁热抽滤。将得到的滤液慢慢加入到盛有适量15%硫酸溶液的烧杯中,析出黄色沉淀,抽滤,冷水洗涤,干燥得粗产品。
(1) 在步骤1中“搅拌”是用电动搅拌器完成的,这样操作的好处有________、________。
(2) 在三颈烧瓶中,随着浓硫酸的加入,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是________。
(3) 在步骤2中,抽滤所得固体的主要成分是________。抽滤装置所包含的仪器除减压系统外,还有________、________(填仪器名称)。
(4) 步骤3用NaOH溶液进行处理的作用主要是____。
用NaOH溶液处理后,需50 ℃温热后抽滤的原因是____。
(5) 制得的粗产品需要进一步精制(纯化),根据对硝基苯甲酸的有关性质可知,对其进行精制(纯化)可以用乙醇溶液完成,也可以采用________法完成。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(14分)草酸是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸。某学习小组的同学拟以甘蔗渣为原料用水解—氧化—水解循环进行制取草酸。
|
 请跟据以上信息回答下列问题:
请跟据以上信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(19分)黄铜矿的主要成分是CuFeS2(硫元素显 价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:
已知:
 =
=
(1)在实验室中,应将黄铜矿粉末放在__________(填仪器名称)中焙烧。
(2)将反应过程中产生的SO2和H2S通入下图所示装置中检验它们的性质。该实验证明SO2具有_________性和__________性。
(3)欲选用下列部分装置在实验室中以MnO2和浓盐酸为原料制取纯净、干燥的氯气。 
①圆底烧瓶中发生反应的离子方程式为_________________________________________。
②按气流方向由左到右,导管口连接顺序为a→__________________________________。
③装置连接好后,在装药品前,需检验装置的气密性,具体方法是__________________。
④向滤液A中通入C12,某同学取通入C12后的溶液滴加KSCN溶液,用来证明C12的氧化性比Fe3+强的结论。该实验设计是否合理________(填“是”或“否”),请用简要文字解释你的理由_____________________________________________________________。
(4)若使用20 g黄铜矿粉末可制得8 gFe2O3(铁红),则该黄铜矿中含CuFeS2的质量分数是________ (假设各步反应均完全进行且过程中无额外物质损耗)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫酸铜晶体俗称“胆矾”,在无机化工及生产生活中有广泛的应用。某课外研究小组的同学用粗铜粉(含有碳等杂质)设计了两种制备胆矾的途径,并测定了其中结晶水的含量。设计的流程如下: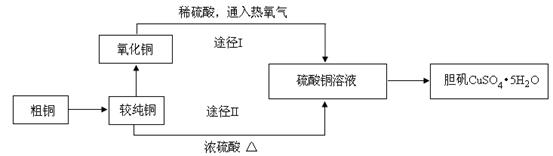
(1)“较纯铜”转化为氧化铜时,应将其置于 内进行灼烧(填写仪器名称)。“粗铜”表面的油脂可以用热碱溶液洗去,原因是 。若灼烧“粗铜”,获得的产物是混有少量铜的氧化铜。存在少量铜的可能原因是 。
a.灼烧过程中部分氧化铜被还原 b.该条件下铜无法被氧气氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧不充分铜未被完全氧化
(2)通过途径I实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤是:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。比较由粗制氧化铜制取胆矾的两种途径,途径Ⅰ有明显的两个优点:
① 。
② 。
(3)测定胆矾晶体里结晶水的含量时,若测定的相对误差大于零,则产生误差的原因可能是___________。
a.加热后容器未放入干燥器中冷却
b.最后两次加热后的质量相差较大
c.加热前称量时容器未完全干燥
d.加热过程中有少量溅失
(4)利用下图装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃。反应前后各装置的质量见图下方的表格所示。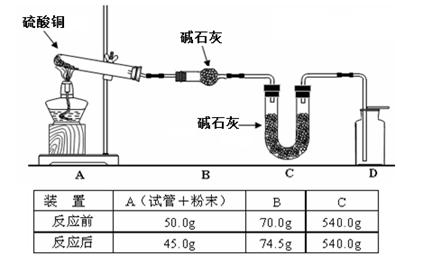
请通过计算,推断该实验条件下硫酸铜分解的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com