


科目:高中化学 来源: 题型:
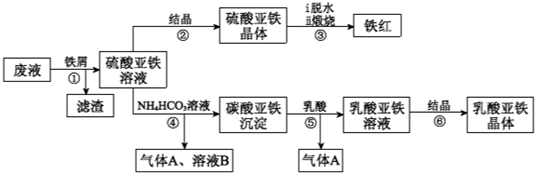
| 13.9 |
| a |
| 13.9 |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2Fe(SO4)2?6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
| 1 |
| V |
| 1 |
| V |
查看答案和解析>>
科目:高中化学 来源: 题型:
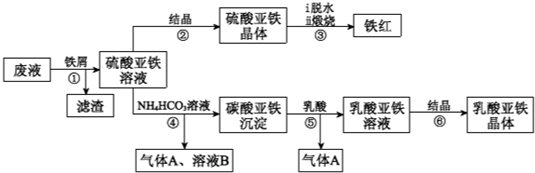
| 13.9 |
| a |
| 13.9 |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市高三上学期期中考试化学试卷(解析版) 题型:填空题
铁盐、亚铁盐是实验室常用的药品。根据题意完成下列填空:
(1)若向硫酸亚铁溶液中滴加稀硝酸,可以看到溶液逐渐变黄。为检验最后溶液中是否还有亚铁离子剩余,可以_____________________________________________;向已酸化的FeCl3溶液中逐滴加入Na2S溶液,有浅黄色沉淀生成,溶液逐渐变为浅绿色。写出该反应的离子方程式 。
(2)向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加H2O2,溶液变红,继续滴加H2O2,红色逐渐褪去,且有气泡产生。呈红色的物质是 (写化学式)。
已知:11H2O2+2SCN—→2SO42—+2CO2↑+ N2↑+10H2O +2H+ 若生成1mol N2,H2O2和SCN—的反应中转移电子物质的量是 mol。
(3)由以上实验,推断Fe2+、S2—和SCN—的还原性强弱 (按从强到弱顺序排列)。
(4)向FeCl3溶液中加入KOH溶液至过量,微热,再通入Cl2,可观察到溶液呈紫色(高铁酸钾:K2FeO4)。写出此过程的离子方程式、配平并标出电子转移的数目和方向 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com