
某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是________。
A.冷水 B.沸水
C.NaOH浓溶液 D.NaCl浓溶液
(2)写出制备Fe(OH)3胶体的化学方程式:____________________________。
(3)怎样用最简捷的方法检验制得的物质是胶体?__________________________ _________________________________________________________________________。
(4)取少量制得的胶体加入试管中,加入(NH4)2SO4溶液,现象是____________________,这种现象称为胶体的______________________。
(5)氢氧化铁胶体稳定存在的主要原因是________。
A.胶体微粒直径小于1 nm B.胶体微粒带正电荷
C.胶体微粒做布朗运动 D.胶体微粒能透过滤纸
(6)Fe(OH)3胶体区别于FeCl3溶液的最本质特征是________。
A.Fe(OH)3胶体微粒的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔现象
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
解析: (1)FeCl3在冷水中反应程度小,不能形成Fe(OH)3胶体;FeCl3与NaOH浓溶液反应生成Fe(OH)3沉淀。
(2)书写方程式时不能写成“Fe(OH)3↓”的形式。
(3)丁达尔现象是区别胶体与溶液的最简捷的方法。
(4)Fe(OH)3胶粒所带正电荷被SO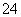 所带负电荷中和,产生红褐色沉淀。
所带负电荷中和,产生红褐色沉淀。
(5)Fe(OH)3胶体稳定存在的主要原因是胶体微粒带正电荷,互相排斥不易形成沉淀;布朗运动是胶体稳定存在的次要原因。
答案: (1)B (2)FeCl3+3H2O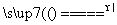 Fe(OH)3(胶体)+3HCl (3)利用丁达尔现象:让一束光线通过制得的物质,从侧面观察到一条光亮的“通路”,说明制得的物质是胶体 (4)产生红褐色沉淀 聚沉 (5)B (6)A
Fe(OH)3(胶体)+3HCl (3)利用丁达尔现象:让一束光线通过制得的物质,从侧面观察到一条光亮的“通路”,说明制得的物质是胶体 (4)产生红褐色沉淀 聚沉 (5)B (6)A


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
人们常利用化学反应中的能量变化为人类服务。
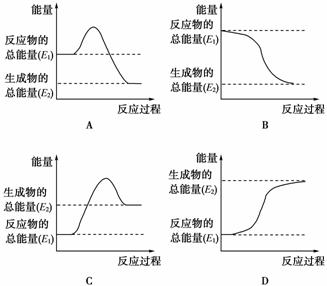
(1)煤是一种重要的燃料,在点燃条件下燃烧,放出大量的热。其在燃烧过程中能量的变化与下列示意图中的________(填字母代号)最相符。
(2)将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手使袋内两种固体粉末充分混合,便立即产生低温,这种“冰袋”可用于短时间保鲜食物。则碳酸钠与硝酸铵的总能量________(填“高于”或“低于”)反应后生成产
物的总能量。
(3)化学反应中的能量变化不仅仅表现为热能的变化,有时还可以表现为其他形式的能量变化。比如,停电时,人们一般点蜡烛来照明,这是将化学能转化为________;人们普遍使用的干电池,是将化学能转化为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列示意图与对应的反应情况正确的是
A.含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2
B.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液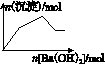
C.NaHSO4溶液中逐滴加入Ba(OH)2溶液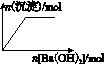
D.NaAlO2溶液中逐滴加入稀盐酸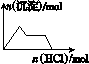
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的 极
(填“正”或“负”),负极反应式为 ;用这种方法处理SO2废气的优点是
。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
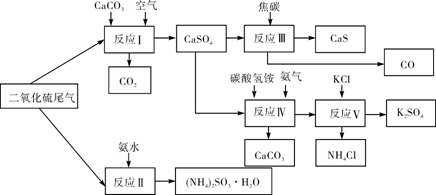
① 生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是
。
② 下列有关说法正确的是 (填序号)。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应III中发生反应的化学方程式为CaSO4+4C  CaS+4CO↑
CaS+4CO↑
C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应V中的副产物氯化铵可用作氮肥
 ③ 反应V中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率
③ 反应V中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率
超过90%,选用40%的乙二醇溶液做溶剂的原因是 。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将某溶液逐滴加入到氢氧化铁胶体中,开始产生沉淀,后又溶解的是( )
A.2 mol·L-1的氢氧化钠溶液 B.2 mol·L-1的硫酸溶液
C.2 mol·L-1的硫酸镁溶液 D.2 mol·L-1的乙醇溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
物质A在水中发生电离,其电离方程式为A===X2++2Y-,则下列判断错误的是(双选)( )
A.A可以是盐类 B.A可以是酸类
C.A可以是碱类 D.A可以是酸、碱或盐
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2SO2+O2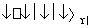 2SO3经过一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )
2SO3经过一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )
A.0.1 s B.2.5 s
C.5 s D.10 s
查看答案和解析>>
科目:高中化学 来源: 题型:
某河道两旁有甲乙两厂,它们排放出的工业废水中共含K+、Ag+、Fe3+、Cl-、OH-、NO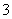 六种离子。
六种离子。
甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、________、________。
乙厂的废水中含有另外三种离子,如果加一定量的________(选填“活性炭”、“硫酸亚铁”或“铁粉”)可以回收其中的金属________(填写金属元素符号)。另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的__________(填写离子符号)转化为沉淀,经过滤后的废水主要含有__________,可用来浇灌农田。
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图所示装置,做以下两个实验:

(1)常温下将H2S和SO2以体积比1∶1充满烧瓶,不久后烧瓶中能观察到的现象是________________________________________________________________________
________________________________________________________________________。
(2)若用Cl2代替SO2,其余同上,观察到的现象与(1)相同之处为______,不同之处为____________________,试用简要的文字和化学方程式解释原因___________________
________________________________________________________________________。
(3)若想使(2)反应后烧瓶内产生“喷泉”现象,引发的操作是__________________
______________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com