
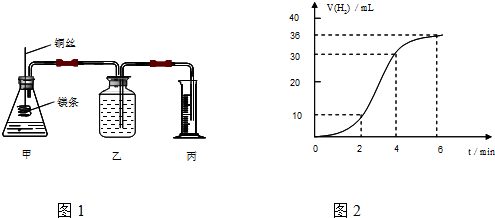
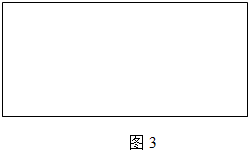
分析 (1)①先根据图2找出2、4、6min时刻时的氢气体积的变化量,再找出2、4、6min时刻时的速率与时间的关系,然后用平滑曲线描绘图象;
②根据该反应的反应热及溶液中氢离子的浓度判断;
(2)①原因Ⅱ:先确定Cl-对反应没有影响再猜测硫酸根离子的作用;
原因Ⅴ:根据原因Ⅳ提出与原因Ⅴ相反的观点;
②根据a、b对比实验中的现象判断原因Ⅲ.
解答 解:(1)①2、4、6min时刻时氢气体积的分别为10 mL、20mL、36mL,其平均反应速率分别为5 mL/min、7.5mL/min、6mL/min,然后标出速率与时间图象为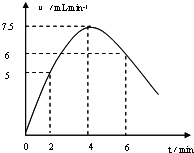 ,故答案为:
,故答案为:
②该反应是放热反应,随着反应的进行,放出的热量越多,溶液的温度越高,反应速率越大;随着反应的进行,溶液中氢离子的浓度逐渐减小,浓度越小,反应速率越小,
故答案为:镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大;4min后由于溶液中H+浓度降低,所以导致反应速率减小;
(2)①Ⅱ根据原因Ⅰ结合题意,提出与原因Ⅰ相反的观点,
故答案为:Cl-对反应没有影响,而SO42-对反应具有阻碍作用;
Ⅴ根据原因Ⅳ结合题意,提出与原因Ⅳ相反的观点,
故答案为:Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大);
②a中原来时快有硫酸根离子,后加入氯离子,如果氯离子有促进作用,那么反应速率就比未加时快,以此证明原因Ⅲ是正确的.
b中中原来时快有氯离子,后加入硫酸根离子,如果硫酸根离子有阻碍作用,那么反应速率比未加时慢,以此说明因Ⅲ是正确的.
故答案为:反应速率加快;反应速率减慢.
点评 本题考查化学反应速率的实验探究,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握实验原理,为解答该题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 20% | C. | 40% | D. | 35% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
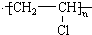 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | B. | 烃类分子中可能含有氧元素 | ||
| C. | 化学用语:乙酸乙脂笨 | D. | 烷烃的通式为CnH2n+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
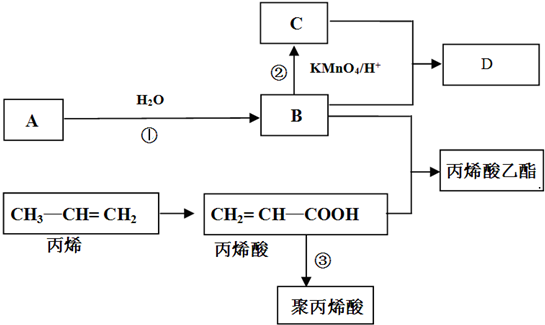
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
.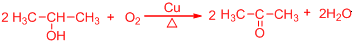 .
.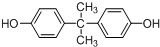 所示,下列说法正确的是ab.
所示,下列说法正确的是ab. .
.
 (其中两种)
(其中两种)查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| A | FeCl2溶液 | FeCl3 | KSCN溶液 |
| B | Fe粉 | A1粉 | HC1溶液 |
| C | Fe2(SO4)3溶液 | FeSO4 | C12 |
| D | FeCl2溶液 | CuCl2 | Fe粉 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该条件下32g S(s)完全燃烧放出的热量为297.23kJ | |
| B. | 反应S(g)+O2(g)═SO2(g)的△H大于-297.3kJ•mol-1 | |
| C. | 反应S(g)+O2(g)═SO2(g)的△H小于-297.3kJ•mol-1 | |
| D. | 形成1 mol SO2(g)中的化学键所释放的总能量大于断裂1 mol S(s)和1mol O2(g)中的化学键所吸收 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com