
【题目】煤燃烧产生的烟气含有的SO2,是大气主要污染物之一。减少煤燃烧对大气造成的污染,应从多方面采取措施。
(1)在煤燃烧前需对煤进行脱硫处理。
①一种烟气脱硫技术是向煤中加入适量石灰石,可大大减少燃烧产物中SO2的含量,最后生成CaSO4,该反应的化学方程式为_________________________________________。
②煤炭中以FeS2(铁元素为+2价)形式存在的硫,可以采用微生物脱硫技术脱去,其原理如图所示:
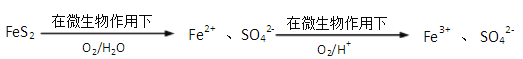
1mol FeS2完全转化为Fe3+ 和SO42-时,FeS2与O2物质的量之比为_____________。
(2)燃煤后烟气脱硫方法之一是利用天然海水的碱性吸收烟气中SO2并转化为无害的SO42-,其流程的示意图如下:
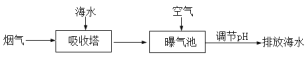
①海水中碳元素主要以HCO3-的形式存在。用离子方程式表示海水呈碱性的原因:_____________。
②研究表明,进入吸收塔的海水温度越低,SO2的脱除效果越好,主要原因是_____________。
③从吸收塔排出的海水呈酸性,并含有较多的HSO3-,排入曝气池进行处理时,需要鼓入大量空气。空气的作用是____________________________________。
【答案】2CaCO3+2SO2 +O2![]() 2CaSO4 +2CO24: 15HCO3- + H2O
2CaSO4 +2CO24: 15HCO3- + H2O ![]() H2CO3 + OH-海水温度越低,SO2在其中的溶解度越大(其他答案合理给分)将HSO3-氧化为SO42-
H2CO3 + OH-海水温度越低,SO2在其中的溶解度越大(其他答案合理给分)将HSO3-氧化为SO42-
【解析】
(1)①向煤中加入石灰石起固硫的作用,该反应的化学方程式是:2CaCO3+2SO2 +O2![]() 2CaSO4 +2CO2;
2CaSO4 +2CO2;
②1mol FeS2完全转化为Fe3+ 和SO42-时,铁元素由+2价变为+3价,硫元素由-1价变为+6价,氧元素由0价变为-2价,故FeS2与O2的计量数为4和15,故物质的量之比为4: 15;
(2)①海水中碳元素主要以HCO3-的形式存在。HCO3-水解使溶液呈碱性,故海水呈碱性的原因为:HCO3- + H2O ![]() H2CO3 + OH-;
H2CO3 + OH-;
②海水温度越低,SO2在其中的溶解度越大,故进入吸收塔的海水温度越低,SO2的脱除效果越好;
③从吸收塔排出的海水呈酸性,并含有较多的HSO3-,排入曝气池进行处理时,需要鼓入大量空气,将HSO3-氧化为SO42-。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z是一种短周期元索,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生右下图转化关系.其中R为10电子分子,是一种常见的无机溶剂。下列说法中不正确的是
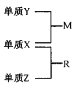
A. X元素位于周期表中第16列
B. X、Y、Z元素两两之间均能形成原子个数比为l:1的化合物
C. X、Y、Z元素形成的单质均具有强还原性
D. R的沸点高于M的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Na2CO3和NaHCO3的性质,下列叙述中错误的是( )
A. 相同温度下,等浓度的Na2CO3溶液和NaHCO3溶液的碱性比较,前者更强
B. 常温时水溶性:Na2CO3>NaHCO3
C. 在酒精灯加热的条件下,前者不分解,后者分解
D. 将澄清的石灰水分别加入Na2CO3和NaHCO3溶液中,前者产生沉淀,后者不产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是

A. a先通入CO2,然后b通入NH3,c中放碱石灰
B. a先通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C. b先通入NH3,然后a通入CO2,c中放碱石灰
D. b先通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.92gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况,忽略N2O4),则反应中消耗HNO3的物质的量为
A. 1molB. 0.05molC. 1.05molD. 0.11mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各装置图的叙述,不正确的是
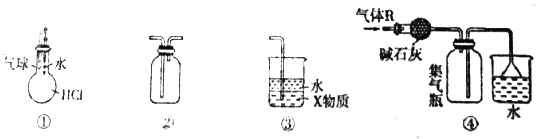
A. 装置①可验证HCl气体在水中的溶解性
B. 装置②可用于收集H2、Cl2、NO2、NO等气体
C. 装置③中X为四氯化碳时,可用于吸收氨气或氯化氢
D. 装置④可用于干燥、收集并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究溶液中AgNO3和Na2S的反应。
实验 | 试剂 | 现象 | |
| 试管 | 滴管 | |
(pH = 4) |
(pH = 9) | 出现黑色沉淀 | |
(1)用离子方程式解释Na2S溶液pH > 7的原因:________。
(2)实验小组同学认为黑色沉淀中可能含有Ag2O、Ag2S或Ag,设计实验验证。
已知:i.浓硝酸能将Ag2S转化为![]() 和
和![]() ;
;
ii.Ag2O能溶解在浓氨水中形成银氨溶液,而Ag2S和Ag均不能。
① 设计并实施如下实验,证实沉淀中含有Ag2S。

试剂1和试剂2分别是_________、_________。
现象1和现象2分别是_________、_________。
② 设计并实施如下实验,证实沉淀中不含有Ag2O,将实验操作和现象补充完整。
实验操作 | 实验现象 | |
步骤i | 取少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
步骤ii | 取少量洗涤后的黑色沉淀,____________ | ____________ |
③ 经检验,沉淀不含有Ag。

(3)实验小组同学认为AgNO3溶液具有氧化性,在一定条件下能够氧化Na2S,设计实验进行研究(实验装置如右图所示),测得电压为a(![]() )。
)。
对AgNO3溶液中氧化![]() 的物质进行推测:
的物质进行推测:
假设1: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() ;
;
假设2: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() 。
。
利用右图装置继续研究(已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
① 将![]() 的AgNO3溶液替换为_______溶液,记录电压为b(
的AgNO3溶液替换为_______溶液,记录电压为b(![]() )。
)。
② 上述实验证实了氧化![]() 的物质中一定包含
的物质中一定包含![]() ,其证据是______。
,其证据是______。
实验结论:AgNO3溶液与Na2S溶液的反应类型与反应条件有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在离子 RO3n 中, 共有 x 个核外电子,R 原子的质量数为 A,则 R 原子核内含有的中子数目是( )
A. A-x+n+24 B. A-x+n+48
C. A-x-n-24 D. A+x-n-24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,按单质、化合物、混合物的顺序排列正确的是( )
A.生石灰、熟石灰、冰水混合物B.氮气、浓硫酸、胆矾
C.干冰 、铁、氯化氢D.水银、水蒸气、空气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com