
| A. | H2SO4溶液 | B. | AgNO3溶液 | C. | NaOH溶液 | D. | KSCN溶液 |
科目:高中化学 来源: 题型:解答题
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | H2 | CO | CH4 |
| 燃烧热(kJ•mol-1) | 285.8 | 283.0 | 890.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 5:7 | D. | 7:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入粉末质量/g | 13.68 | 27.36 | 34.20 |
| 生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8mol/(L•s) | B. | 2.0mol/(L•s) | C. | 4.0mol/(L•s) | D. | 6.0mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
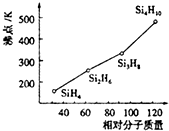
| 实验 | 实验现象 | 结论 |
| A | 无色溶液变蓝 | I-在酸性条件下被氧气氧化为I2 |
| B | 溶液均呈红色,且深浅一样 | 相同浓度的CO32-与HCO3-水解能力相同 |
| C | 产生白色沉淀又逐渐变成红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 溴的四氯化碳溶液颜色褪去 | 石蜡催化加热反应产物为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
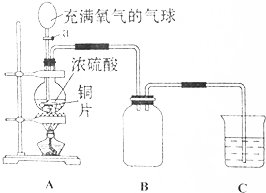 小明同学设计了如图所示装置探究铜跟浓硫酸的反应.先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余.接着再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢减少.
小明同学设计了如图所示装置探究铜跟浓硫酸的反应.先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余.接着再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢减少.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com