
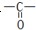 和C-OH两种原子团,A可能的结构简式为(写出一种即可)
和C-OH两种原子团,A可能的结构简式为(写出一种即可)| 3.6g |
| 18g/mol |
| 8.8g |
| 44g/mol |
| v |
| vm |
| 4.48L |
| 22.4L/mol |
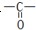 和C-OH两种原子团,所以A可能为羧酸或羟醛物质,羧酸应为CH3COOH,一个羧基可拆成一个羟基和一个醛基,所以含有羟基和醛基的物质为CH2(OH)CHO,故答案为:CH3COOH或CH2(OH)CHO.
和C-OH两种原子团,所以A可能为羧酸或羟醛物质,羧酸应为CH3COOH,一个羧基可拆成一个羟基和一个醛基,所以含有羟基和醛基的物质为CH2(OH)CHO,故答案为:CH3COOH或CH2(OH)CHO.


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
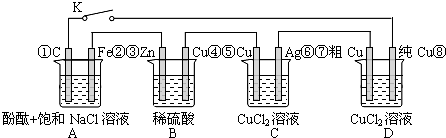
| A、当K闭合时,A装置发生吸氧腐蚀,在电路中做电源 |
| B、当K断开时,B装置锌片溶解,有氢气产生 |
| C、当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→② |
| D、当K闭合后,A、B装置中pH变大,C、D装置中pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.08克 |
| B、1.44克 |
| C、1.8 克 |
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某装置如图所示,该装置工作过程中,下列判断错误的是( )
某装置如图所示,该装置工作过程中,下列判断错误的是( )| 甲池 | 乙池 | |
| A | Zn极:Zn-2e-=Zn2+ | Cu极:Cu-2e-=Cu2+ |
| B | Cu2+移向C电极 | Cl-移向Fe电极 |
| C | 每消耗1mol Zn | 生成1mol气体 |
| D | C极的质量增加a g | Cu极的质量减小a g |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、央视曝光“毒胶囊”事件,主要是其中重金属含量超标,重金属对人体危害主要是使蛋白质变性 |
| B、大量焚烧田间秸秆会产生雾霾,“雾”和“霾”的分散质微粒相同 |
| C、人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 |
| D、针对H7N9流感的扩散情况,常选用含氯消毒剂、双氧水等物质进行消毒预防 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com