
分析 (1)C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1 ①
C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+90kJ•mol-1 ②
由盖斯定律②-①得CO(g)+H2O(g)=CO2(g)+H2(g),以此计算△H;
(2)a.随温度升高,平衡向吸热即正反应方向移动,氨气的物质的量逐渐减小;
b.随压强增大,平衡向气体体积减小即逆反应反应移动,氨气的转化率逐渐减小;
c.随反应进行,密闭体积中混合气体的密度自始至终不变;
d.随氨气的物质的量增加,某一生成物的物质的量逐渐增加;
(3)a.一氧化氮不易溶于,而二氧化氮易溶于水,反应生成NO;
b.亚硫酸钠不稳定,易被氧气氧化;
c.用CO作脱除剂,则氮氧化物得电子发生还原反应;
d.尿素[CO(NH2)2]中N元素化合价为-3价,具有还原性,在一定条件下能有效将NOx转化为氮气;
(4)①相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大;
②温度容积不变,向该密闭容器再增加a mol CO与 2a mol H2,等效为开始加入2a mol CO与 4a mol H2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动;平衡常数只受温度影响,温度不变,平衡常数不变;
③该温度下,平衡时n(CO)=amol×(1-0.5)=0.5amol,n(CH3OH)=c(CO)(参加反应)=amol×0.5=0.5amol,n(H2)=2amol-2×amol×0.5=amol,则c(CO)=$\frac{0.5a}{V}$mol/L、c(CH3OH)=$\frac{0.5a}{V}$mol/L、c(H2)=$\frac{a}{V}$mol/L,化学平衡常数K=$\frac{c(CO)×c{\;}^{2}(H{\;}_{2})}{c(CH{\;}_{3}OH)}$计算;
(5)①将2mol NH3(g)和l mol CO2(g)通入1L水中,恰好生成碳酸铵,据此分析即可;
②依据电中性原则列出式子,代入数据计算即可.
解答 解:(1)C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1 ①
C(s)+2H2O(g)=CO2(g)+2H2(g)△H2=+90kJ•mol-1 ②
由盖斯定律②-①得:
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.3kJ•mol-1
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.3kJ•mol-1;
(2)a.当X表示温度时,平衡向吸热即正反应方向移动,氨气的物质的量逐渐减小,故a正确;
b.当X表示压强时,平衡向气体体积减小即逆反应反应移动,氨气的转化率逐渐减小,故b正确;
c.当X表示反应时间时,密闭体积中混合气体的密度自始至终不变,故c错误;
d.当x表示氨气的物质的量时,某一生成物的物质的量逐渐增加,故d错误;
故答案为:ab;
(3)a.一氧化氮不易溶于,而二氧化氮易溶于水,反应生成NO,不利于吸收含氮烟气中的NO,故a正确;
b.亚硫酸钠不稳定,易被氧气氧化,O2会降低Na2SO3的利用率,故b正确;
c.用CO作脱除剂,被氧化,则氮氧化物得电子发生还原反应,不会生成NO2,烟气中NO2的浓度不增加,故c错误;
d.尿素[CO(NH2)2]中N元素化合价为-3价,具有还原性,在一定条件下能有效将NOx转化为N2.故d正确.
故答案为:abd;
(4)①相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大,根据图象知,p1小于p2,故答案为:<;
②温度容积不变,向该密闭容器再增加a mol CO与 2a mol H2,等效为开始加入2a mol CO与 4a mol H2,体积扩大1倍,平衡后增大压强,再压缩恢复到原来体积,增大压强平衡向体积减小的方向移动.该反应为气体体积减小的反应,故向正反应移动,CO转化率增大.平衡常数只受温度影响,温度不变,平衡常数不变.
故答案为:增大;不变;
③该温度下,平衡时n(CO)=amol×(1-0.5)=0.5amol,n(CH3OH)=c(CO)(参加反应)=amol×0.5=0.5amol,n(H2)=2amol-2×amol×0.5=amol,则c(CO)=$\frac{0.5a}{V}$mol/L、c(CH3OH)=$\frac{0.5a}{V}$mol/L、c(H2)=$\frac{a}{V}$mol/L,化学平衡常数K=$\frac{c(CO)×c{\;}^{2}(H{\;}_{2})}{c(CH{\;}_{3}OH)}$=$\frac{\frac{0.5a}{V}×(\frac{a}{V}){\;}^{2}}{\frac{0.5a}{V}}$=$\frac{a{\;}^{2}}{V{\;}^{2}}$,故答案为:$\frac{a{\;}^{2}}{V{\;}^{2}}$;
(5)①将2mol NH3(g)和l mol CO2(g)通入1L水中,恰好生成碳酸铵,化学反应方程式为:2NH3+CO2+H2O=(NH4)2CO3,故溶液中存在浓度最大的阴离子是碳酸根,故答案为:CO32-;
②设两种溶液体积均为V,混合后,该溶液中的阳离子是:Na+、NH4+和H+,阴离子是:OH-和SO42-,依据电中性原则有:c(Na+)+c(NH4+)+c(H+)=2c(SO42-)+c(OH-),故c(Na+)+c(NH4+)=2c(SO42-)+c(OH-)-c(H+)=2×$\frac{0.01mol/L×1L}{1L+1L}$+$\frac{10{\;}^{-14}}{10{\;}^{-10}}$-10-10=0.01+10-4-10-10=10-2+10-4-10-10,故答案为:10-2+10-4-10-10.
点评 本题主要考查的是反应的焓变判断,热化学方程式的书写,化学平衡的影响因素,氧化还原法除有毒气体,可逆反应转化率随温度和压强变化的曲线,要求学生具备依据图象所给的信息获取分析问题的能力,还涉及平衡常数的计算、溶液中离子浓度大小比较以及电中性原则的应用,有一定难度.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| B. | 明矾常作为净水剂,双氧水通常可用于杀菌消毒 | |
| C. | 金属钠、镁等活泼金属着火时,可以使用泡沫灭火器来灭火 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
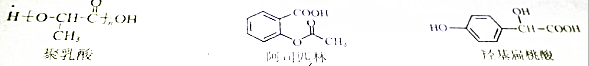
| A. | 三种有机物都能发生酯化反应 | |
| B. | 聚乳酸分子中存在酯基、羧基、羟基 | |
| C. | 羟基扁桃酸在浓硫酸作用下能生成含三个六元环结构的有机物 | |
| D. | 等物质的量的阿司匹林与羟基扁桃酸能消耗的NaOH的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | 元索周期表中核电荷数最小的元素 |
| Y | Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质 |
| Z | Z是大气中含量最多的元素,其某些氧化物为大气中常见的污染物 |
| W | W是地壳中含量最高的金属元素 |
| M | 常见金属,单质呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com