
分析 在标准状况下,乙烷与某烷烃的混合气体1.344L,混合气体物质的量=$\frac{1.344L}{22.4L/mol}$=0.06mol,氢氧化钠的物质的量=0.3L×0.4mol/L=0.12mol,假设氢氧化钠完全反应,若最终得到固体为碳酸钠,则固体质量=0.06mol×106g/mol=6.36g,若碳酸氢钠,则其质量=0.12mol×84g/mol=10.08g,故7.6g固体为NaHCO3、Na2CO3混合物,令NaHCO3、Na2CO3的物质的量分别为xmol、ymol,根据二者质量与钠离子守恒列方程计算,根据原子守恒计算混合气体分子中平均碳原子数,确定故另外烷烃分子.
解答 解:在标准状况下,乙烷与某烷烃的混合气体1.344L,混合气体物质的量=$\frac{1.344L}{22.4L/mol}$=0.06mol,氢氧化钠的物质的量=0.3L×0.4mol/L=0.12mol,假设氢氧化钠完全反应,若最终得到固体为碳酸钠,则固体质量=0.06mol×106g/mol=6.36g,若碳酸氢钠,则其质量=0.12mol×84g/mol=10.08g,故7.6g固体为NaHCO3、Na2CO3混合物,
令NaHCO3、Na2CO3的物质的量分别为xmol、ymol,根据二者质量与钠离子守恒,则:
$\left\{\begin{array}{l}{x+2y=0.12}\\{84x+106y=7.6}\end{array}\right.$
解得x=0.04 y=0.04,
根据原子守恒可知混合气体分子中平均碳原子数目=$\frac{0.04mol+0.04mol}{0.06mol}$=$\frac{4}{3}$,故另外烷烃分子中含有1个C原子,故为CH4,
答:(1)7.6g固体的成分是0.04molNaHCO3和0.04molNa2CO3;
(2)该混合气体中出乙烷外,另一种烃是CH4.
点评 本题考查混合物计算、有机物分子式的确定,利用极限法判断蒸干后固体成分是关键,再根据原子守恒解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L甲苯所含的分子数约为NA | |
| B. | 室温下,2.8g乙烯与丙烯的混合物中含碳原子的数目为0.2NA | |
| C. | 1 mol C30H62分子中含有共价键的数目为92NA | |
| D. | 1 mol氯气和足量甲烷在光照条件下反应可生成2NA个氯化氢分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
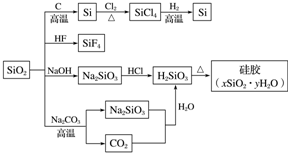
| A. | SiO2属于两性氧化物 | |
| B. | 盛放Na2CO3溶液的试剂瓶能用玻璃塞 | |
| C. | 图中所示转化反应都是氧化还原反应 | |
| D. | 硅胶吸水后可重复再生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2与2molNaHCO3固体混合物在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是NaOH和Na2CO3 | |
| B. | 由Na2O、Na2O2、Na2CO3•10H2O组成的混合物0.05 mol,溶于水后加入50 mL 2 mol/L的盐酸恰好完全反应,则原混合物中各成分的物质的量之比可以为任意值 | |
| C. | 向Na2 CO3饱和溶液中通入CO2,溶液变浑浊有晶体析出 | |
| D. | 将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是Na2O和Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程.请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定.学习小组的同学设计了滴定的方法测定x值.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程.请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定.学习小组的同学设计了滴定的方法测定x值.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | 除④⑥⑦以外 | C. | ③④⑤⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2g | B. | 6.4g | C. | 12.8g | D. | 21.6g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com