
分析 (1)根据原子守恒可知未知的产物为2个HCl,则反应方程式为2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,Mn元素的化合价降低,Cl元素的化合价降低;
(2)反应中KMnO4得电子,作氧化剂,HCl失电子,作还原剂,根据电子守恒计算;
(3)反应中生成1mol氯气转移2mol电子;
(4)根据氯原子守恒计算.
解答 解:(1)根据原子守恒可知未知的产物为2个HCl,则反应方程式为2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,Mn元素的化合价降低,Cl元素的化合价降低,转移电子的表示方法为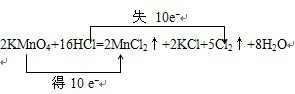 ,
,
故答案为:2HCl; ;
;
(2)反应中KMnO4得电子,作氧化剂,HCl失电子,作还原剂,1molKMnO4得5mol电子,1molHCl失去5mol电子,则氧化剂与还原剂物质的量之比是1:5;
故答案为:1:5;
(3)反应中生成1mol氯气转移2mol电子,电子转移的数目为6.02×1023个即1mol,则生成0.5mol氯气;
故答案为:0.5;
(4)用该盐酸制得了标况下560mLCl2,则n(Cl2)=$\frac{V}{{V}_{m}}$=$\frac{0.56L}{22.4L/mol}$=0.025mol,由原子守恒可知n(HCl)=2n(Cl2)=0.025mol×2=0.05mol;
故答案为:0.05.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 汽油、柴油和植物油都是碳氢化合物 | |
| B. | 葡萄糖和银氨溶液发生银镜反应可用作制镜子 | |
| C. | 往花生油中加入稀硫酸能发生皂化反应 | |
| D. | 鸡蛋清中加入胆矾可以使蛋白质发生盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
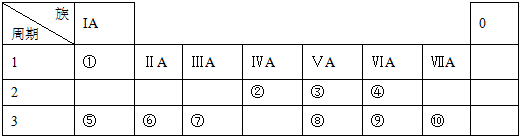
 ;由元素④和元素②形成的化合物的电子式为
;由元素④和元素②形成的化合物的电子式为 ;元素⑦的原子结构示意图为
;元素⑦的原子结构示意图为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将浓硫酸和浓硝酸分别长期露置在空气中,浓度均会降低 | |
| B. | 在常温下,浓硫酸和浓硝酸均能与铜剧烈反应 | |
| C. | 稀硫酸和稀硝酸分别与金属反应时,S和N元素的化合价都会发生变化 | |
| D. | 因为浓硫酸和浓硝酸都能与铁反应,所以常温下二者都不能用铁制容器盛装 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氢氧化钠溶液除去二氧化碳气体中的二氧化硫 | |
| B. | 可用干燥的淀粉碘化钾试纸检验氯气 | |
| C. | 某溶液焰色反应的火焰呈黄色,说明该溶液中肯定含钠离子不确定是否含钾离子 | |
| D. | 用分液漏斗分离水与乙醇的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
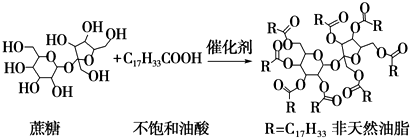
| A. | 蔗糖酯也是高级脂肪酸的甘油酯,属于油脂类物质 | |
| B. | 该非天然油脂与氢氧化钠溶液共热,其水解产物不与溴水反应 | |
| C. | 非天然油脂为高分子化合物 | |
| D. | 该蔗糖酯在稀硫酸的作用下水解,最终可生成三种有机化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
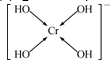 (若有配位键,用箭号表示)
(若有配位键,用箭号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④③②① | C. | ②④①③ | D. | ②①④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠为淡黄色固体 | |
| B. | 过氧化钠与水反应是放热反应 | |
| C. | 过氧化钠可用于呼吸面具中作为氧气的来源 | |
| D. | 过氧化钠与二氧化碳反应是置换反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com