
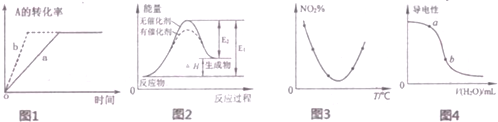
| A. | 图1所示反应:A(g)+2B(g)?3C(g),b曲线表示的一定是增大压强 | |
| B. | 图2表示催化剂能改变化学反应的焓变 | |
| C. | 图3表示等量N02在容积相同的恒容密闭容器中,不同温度下分别发生反应;2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| D. | 图4表示向稀CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
分析 A、b曲线表示的反应比a反应速率快,平衡不移动;
B、催化剂能够降低反应的活化能,不影响焓变;
C、由图可知,反应平衡后升高温度N02的含量增大,平衡逆移,正方向为放热反应;
D、CH3COOH溶液中导电性越强,氢离子浓度越大,pH越小.
解答 解:A、图1所示反应:A(g)+2B(g)?3C(g),b曲线表示的可以是使用催化剂,故A错误;
B、催化剂不影响焓变大小,故B错误;
C、由图可知,反应平衡后升高温度N02的含量增大,平衡逆移,正方向为放热反应,所以该反应的△H<0,故C正确;
D、CH3COOH溶液中导电性越强,氢离子浓度越大,pH越小,则CH3COOH溶液的pH:a<b,故D错误;
故选C.
点评 本题考查了化学图象、阅读题目获取信息的能力等,难度中等,需要学生具备运用信息与基础知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 1mol金刚石晶体中含碳碳键数为2NA | |
| B. | 常温常压下,22.4L的D2、H2组成的气体分子数约为NA | |
| C. | 标准状况下,22.4LSO3中含有的氧原子数约为3 NA | |
| D. | 1molNa2O2与足量CO2反应转移的电子数2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素W、X的氯化物中,各原子均满足最外层8电子的稳定结构 | |
| B. | 元素X与W形成的原子数比为1:1的化合物有很多种,且都存在非极性键 | |
| C. | 非金属性:Z>X | |
| D. | 元素Z可与元素Y形成化合物Y2Z3,该化合物易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1的醋酸溶液中含有0.1NA个H+ | |
| B. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | 25℃时,1LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| D. | 1mol单质硅含有2NA个Si-Si键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
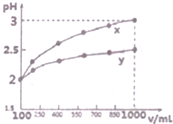 (1)现有浓度为0.1mol•-1的四种溶液①硫酸②醋酸③氢氧化钠④氯化铵.这四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①(填序号).
(1)现有浓度为0.1mol•-1的四种溶液①硫酸②醋酸③氢氧化钠④氯化铵.这四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | ① | ② | ③ | ④ |
| 稀硝酸的体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属的质量/g | 18.0 | 9.6 | 0 | 0 |
| NO的体积/mL | 2240 | 4480 | 6720 | V |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com