
有机物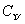 H3
H3 H===CH—
H===CH— ≡CH中标有“·”的碳原子的杂化方式依次为 ( )
≡CH中标有“·”的碳原子的杂化方式依次为 ( )
A.sp、sp2、sp3 B.sp2、sp、sp3 C.sp3、sp2、sp D.sp3、sp、sp2
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
水杨酸酯E为紫外线吸收剂,可用于配制防晒霜。E的一种合成路线如下:
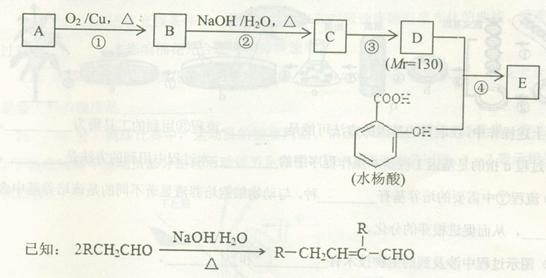
请回答下列问题:
(1)A是分子式为C4H10O的一元醇,分子中只有一个甲基。F与A互为同分异构体,F的核磁共振氢谱图有2组峰,且峰面积比为9:1。则F与浓HBr溶液共热生成有机物的结构简式为 。
(2)B能与新制的Cu(OH)2悬浊液发生反应,该反应的化学方程式为 。
(3)C中所含官能团的名称为 ,若要检验C中所含官能团,一次取样检验,按使用试剂的先后顺序,下列选项中组 (填字母编号)更为合理。
a.银氨溶液、溴水 b.溴水、银氨溶液
c.银氨溶液、稀盐酸、溴水 d.溴水、氢氧化钠溶液、银氨溶液
(4) 第③步的反应类型为 。
(5)同时符合下列条件的水杨酸的同分异构体有 种。
a.分子中含有6个碳原子在同一条直线上
b.分子中所含官能团包括水杨酸具有的含氧官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
已知铅蓄电池Pb + PbO2 + 2H2SO4 ==2PbSO4 + 2H2O 在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。下列说法中正确的是
A.标有“+”的接线柱,充电时作阳极,放电时作负极
B.放电时PbO2作正极,电池工作一段时间后电解质溶液密度会减少
C.充电时电路中通过0.1mol电子时,电解质溶液有0.2molH2SO4 产生
D.充电时阳极中PbSO4 被还原为PbO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1) ⑦元素最高价氧化物晶体类型是______________。
(2) ⑨所在族的各元素的氢化物中沸点最低的是________(写分子式)
(3)不同元素的原子在分子内吸引电子的能力大小可用电负性x来表示,若x越大说明该元素非金属性越强,比较x(⑧) x(⑨)(填>,< 或 =),写出一个支持这一比较的事实(用化学方程式表示) 。
(4) ①、④、⑤中的某两种或三种元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。
(5)元素③的氢化物与元素⑨的氢化物反应的化学方程式为 。已知第二周期ⅡA族元素性质与⑥相似,写出该元素最高价氧化物与NaOH溶液反应的离子方程式_________。
(6) 已知A为ⅡA族元素(第二到第七周期),其原子序数为a,B与A位于同一周期,且为ⅢA族元素,则B的原子序数b与a所有可能的关系是( )
A 、 b=a+1 B 、b=a+9 C、b=a+11 D、 b=a+15
(7) 由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应(已知Z为白色沉淀)
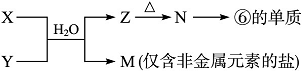
X溶液与Y溶液反应的离子方程式________, M中阳离子的检验方法____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.SO2和SiO2 B.CCl4和KCl C.NaCl和HCl D.CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物X能发生水解反应,水解产物为Y和Z,Z能发生银镜反应。同温同压下,相同质量的Y和Z的蒸气所占体积相同,化合物X可能是( )
A.乙酸丙酯 B.甲酸乙酯 C.甲酸丙酯 D.乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温下,16g CH4含nA个H原子
B.1 mol Fe与足量稀HNO3反应,转移3nA个电子
C.0.1 mol/L NaHCO3溶液中含有0.1nA个Na+
D.常温常压下,22.4L的NO2和CO2混合气体含有2nA个O原子
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)根据下图图示判断,下列说法正确的是( )
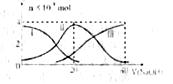 A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)> c(A2-)>c(OHˉ)
A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HAˉ)>c(H+)> c(A2-)>c(OHˉ)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C.NaHA溶液中:c(OH-)+c(A2–)=c(H+)+c(H2A)
D.向Na2A溶液加入水的过程中,pH可能增大也可能减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com