
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径/10-10m | 0.73 | 1.36 | 1.34 | 1.06 | 0.99 | 1.54 | 0.75 | 1.02 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | |||
| -2 | -3 | -2 |
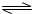 HClO+OH-
HClO+OH-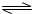 HClO+OH-
HClO+OH-查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| △ |
| ||
| △ |
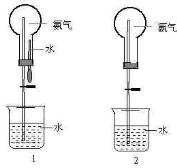
查看答案和解析>>
科目:高中化学 来源: 题型:
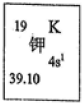 我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题:
我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题:查看答案和解析>>
科目:高中化学 来源:江西省(南昌一中、十中、新建二中)2006-2007学年度高三年级第一学期三校联考、化学试题 题型:013
|
已知下列事实:①高氯酸的酸性比硫酸强.②盐酸是比氢硫酸更强的酸.③氯化氢比硫化氢稳定.④氯气与硫化氢混合可产生单质硫.⑤氯元素、硫元素最高化合价分别是+7、+6价,其中能说明氯元素的非金属性比硫元素强的是 | |
| [ ] | |
A. |
①②③ |
B. |
②④⑤ |
C. |
①③④ |
D. |
②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com