
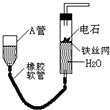
 如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题:
如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题:分析 (1)碳化钙与水反应生成氢氧化钙和乙炔;
(2)酸性KMnO4具有强氧化性,乙炔含有碳碳三键,具有还原性;
(3)乙炔含有碳碳三键,为不饱和烃,能与溴单质发生加成反应;
(4)依据可燃气体燃烧前应先验纯,乙炔含碳量高分析燃烧的现象;
(5)能与溴发生反应的有苯酚、不饱和烃等,生成的乙炔含有硫化氢,可与溴发生氧化还原反应.
解答 解:(1)碳化钙与水反应的化学方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O=Ca(OH)2+C2H2↑;
(3)乙炔含有碳碳三键,具有还原性,能被酸性的高锰酸钾氧化,故答案为:氧化;
(3)乙炔含有碳碳三键,为不饱和烃,能与溴的四氯化碳溶液中的溴单质发生加成反应使其褪色,反应为:CH≡CH+2Br2→CHBr2-CHBr2,
故答案为:CH≡CH+2Br2→CHBr2-CHBr2;
(4)可燃气体燃烧前应先验纯,乙炔含碳量高,燃烧时产生明亮的火焰伴有浓黑烟,方程式为:2 C2H2+5 O2$\stackrel{点燃}{→}$4CO2+2H2O,
故答案为:验纯;明亮的火焰,并伴有大量的浓烟;
(5)生成的乙炔中往往混有硫化氢等气体,可与溴发生氧化还原反应而使溶液褪色,则a、cC正确,b、d错误,
故答案为:a、c.
点评 本题以乙炔的实验室制法为载体考查了乙炔的性质,明确制备乙炔的原理和乙炔的结构式解题的关键,题目难度不大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯和环丙烷 | B. | 甲烷和乙烷 | C. | 丙烯和丙烷 | D. | 丙烷和环丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
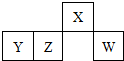 下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 最高价氧化物对应水化物的酸性Y>Z>W | |
| B. | WO2可使酸性高锰酸钾褪色,说明WO2有漂白性 | |
| C. | ZCl4电子式: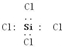 | |
| D. | X的气态氢化物可与W的最高价氧化物对应水化物相互反应生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
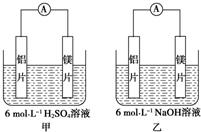 甲、乙两位学生想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
甲、乙两位学生想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20.7% | B. | 22% | C. | 1.3% | D. | 7.3% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com