
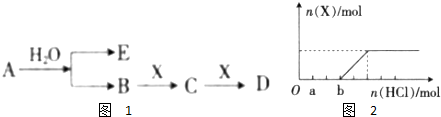
| 2mol��78g/mol |
| 7.8g |
| 2.5��10-9 |
| 0.5 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
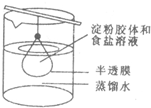 ��10mL������Һ��5mL�Ȼ�����Һ��Ϻ����ð�Ĥ�ƳɵĴ��ڣ����˴���������ˮ�У���ͼ����2min��ֱ�ȡ���ں��ձ���Һ�����ʵ�飮����˵����ȷ���ǣ�������
��10mL������Һ��5mL�Ȼ�����Һ��Ϻ����ð�Ĥ�ƳɵĴ��ڣ����˴���������ˮ�У���ͼ����2min��ֱ�ȡ���ں��ձ���Һ�����ʵ�飮����˵����ȷ���ǣ�������| A���ü����������ձ��е�Һ�壬�������������� |
| B���ձ���Һ������ˮ�����ɫ |
| C���õ��۽����ڴ��������¿�ˮ�����������Ǻ��� |
| D�����ձ���Һ�����ɣ��õ��Ĺ������ʿ�������ȡ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��aԭ�ӵ�������������Bԭ�ӵ������������� |
| B��aԭ�ӵ��Ӳ�����bԭ�ӵĵ��Ӳ����� |
| C��1mol a�������û�H+���ɵ�H2��b�������û�H+���ɵ�H2Ҫ���� |
| D������ʱ��b�ܴ�ˮ���û����⣬��a���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
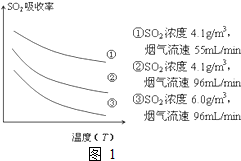 �����������ҹ�����Դ������ռ�ϴ���أ������ŷų���SO2�����һϵ�л�������̬���⣬ֱ���ŷź�SO2���������γ����꣬Σ��������
�����������ҹ�����Դ������ռ�ϴ���أ������ŷų���SO2�����һϵ�л�������̬���⣬ֱ���ŷź�SO2���������γ����꣬Σ��������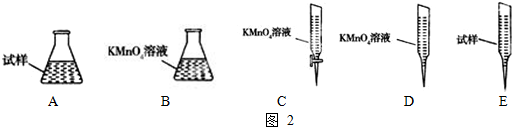
| �ζ����� | ������Һ �����/mL |
����Һ����� | |
| �ζ�ǰ�̶�/mL | �ζ���̶�/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ����� | �� | �� | �� |
| ѹǿ/Pa | 1��105 | 2��105 | 1��106 |
| c��A��mol?L-1 | 0.08 | 0.16 | 0.88 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��d��c��a��b |
| B��b��a��d��c |
| C��d��b��a��c |
| D��d��a��b��c |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 2013��12��2��1ʱ30�֣��������϶����ŵij������������ػ�����������Ƿ������ķ������ղ�ȷ��죬����Բ���ɹ��������һ�Ӽ����������Ͷ��Ӽ�ʹ��ƫ������[��CH3��2NNH2���ṹ��ͼ��ʾ]��N2O4��Ϊ�ƽ�������Ӧ���£���CH3��2NNH2+2N2O4�T2CO2��+4H2O��+3N2���������й�˵����ȷ���ǣ�������
2013��12��2��1ʱ30�֣��������϶����ŵij������������ػ�����������Ƿ������ķ������ղ�ȷ��죬����Բ���ɹ��������һ�Ӽ����������Ͷ��Ӽ�ʹ��ƫ������[��CH3��2NNH2���ṹ��ͼ��ʾ]��N2O4��Ϊ�ƽ�������Ӧ���£���CH3��2NNH2+2N2O4�T2CO2��+4H2O��+3N2���������й�˵����ȷ���ǣ�������| A����NAΪ����٤��������ֵ����46g NO2��N2O4�Ļ�����庬�е���ԭ������2NA��4NA֮�� |
| B��ƫ�����·����мȺ��Ҽ��ֺ��м� |
| C����CH3��2NNH2��N2O4�����ڷ��Ӿ��� |
| D��ÿ��Ӧ1mol ��CH3��2NNH2��44.8L N2O4����ԭ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com