
| 离子 | 离子半径(pm) | 开始沉淀pH | 完全沉淀pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |


科目:高中化学 来源: 题型:


| 离子 | 离子半径(pm) | 开始沉淀pH | 完全沉淀pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
 已知PbO2的氧化性大于MnO2.请回答下列问题:
已知PbO2的氧化性大于MnO2.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
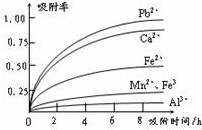
减少SO2的排放、回收利用SO2成为世界性的研究课题。我国研究人员研制的利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下:

浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。
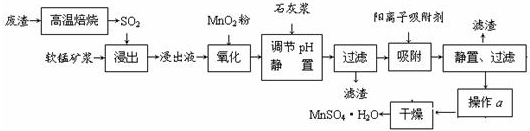
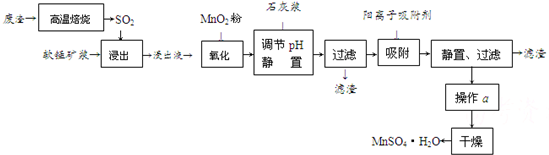
有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
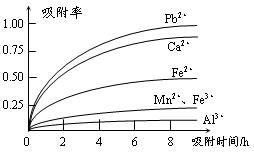
| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
已知PbO2的氧化性大于MnO2。请回答下列问题:
⑴ 写出浸出过程中主要反应的化学方程式 ,氧化过程中主要反应的离子方程式 。
⑵ 在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至 。
⑶ 阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是 (填写序号)。
a.溶液的pH b.金属离子的电荷 c.金属离子的半径 d.吸附时间
⑷ 操作a包括 等过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
减少SO2的排放、回收利用SO2是环保的重要课题。我国研究人员研制的利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下:

浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其它金属离子。
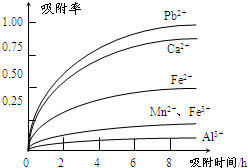
有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |

已知PbO2的氧化性强于MnO2。请回答下列问题:
⑴ 写出浸出过程中主要反应的化学方程式 ,
氧化过程中主要反应的离子方程式 。
⑵ 在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至范围 ,
滤渣的主要成分有 。
⑶ 阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是
(填写序号)。
a.溶液的pH b.金属离子的氧化性 c.金属离子的半径 d.吸附时间
⑷ 操作a包括 过程。
查看答案和解析>>
科目:高中化学 来源:2009年山东省聊城市临清一中高考化学模拟试卷(九)(解析版) 题型:解答题

| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com