
【题目】下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A.2C8H18(l)+25O2(g)![]() 16CO2(g)+18H2O(g) ΔH=11036.0kJ/mol(燃烧热)
16CO2(g)+18H2O(g) ΔH=11036.0kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)![]() NaCl(aq)+H2O(l) ΔH=+57.3kJ/mol(中和热)
NaCl(aq)+H2O(l) ΔH=+57.3kJ/mol(中和热)
C.S(s)+O2(g)![]() SO2(g) ΔH=269.8kJ/mol(反应热)
SO2(g) ΔH=269.8kJ/mol(反应热)
D.Fe+S![]() FeS ΔH=95.6kJ/mol(反应热)
FeS ΔH=95.6kJ/mol(反应热)
【答案】C
【解析】
A、C8H18的燃烧热是1mol C8H18完全燃烧生成二氧化碳和液态水放出的热量,2C8H18(l)+25O2(g)![]() 16CO2(g)+18H2O(g) ΔH=11036.0kJ/mol不能表示燃烧热,故A错误;
16CO2(g)+18H2O(g) ΔH=11036.0kJ/mol不能表示燃烧热,故A错误;
B. 中和反应放热,焓变为负值,NaOH(aq)+HCl(aq)![]() NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol,故B错误;
NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol,故B错误;
C. 化学反应中放出的热量叫反应热,硫燃烧放热,S(s)+O2(g)![]() SO2(g) ΔH=269.8kJ/mol表示反应热,故C正确;
SO2(g) ΔH=269.8kJ/mol表示反应热,故C正确;
D. 热化学方程式要标注聚集状态,Fe+S![]() FeS ΔH=95.6kJ/mol没有标注聚集状态,故D错误。
FeS ΔH=95.6kJ/mol没有标注聚集状态,故D错误。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】探究甲醛与新制的Cu(OH)2的反应:
(1)向6 mL 6 mol·L1 NaOH溶液中滴加8滴2%CuSO4溶液,振荡,加入0.5 mL15%甲醛溶液,混合均匀,水浴加热,迅速产生红色沉淀,其周围剧烈产生无色气体。
(2)反应停止后分离出沉淀,将所得沉淀洗净后加入浓盐酸,不溶解。
(3)相同条件下,甲酸钠溶液与新制的Cu(OH)2反应,未观察到明显现象。
已知:Cu2O![]() [CuCl2],甲醛是具有强还原性的气体。
[CuCl2],甲醛是具有强还原性的气体。
下列说法正确的是
A.红色沉淀的主要成分不是Cu2O,可能是Cu
B.将产生的无色气体通过灼热的CuO后得到红色固体,气体中一定含有CO
C.从甲醛的结构 ![]() 推测,其氧化产物可能为碳酸(
推测,其氧化产物可能为碳酸(![]() ),因此实验中得到的无色气体是CO2
),因此实验中得到的无色气体是CO2
D.含有-CHO的有机物都可以被新制Cu(OH)2氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《神农本草经》记载,神农尝百草,日遇七十二毒,得茶而解。茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
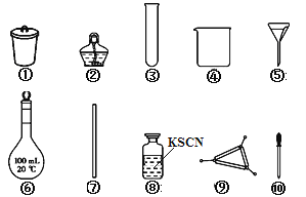
A. 将茶叶灼烧灰化,选用①、②和⑨
B. 用浓盐酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C. 过滤得到滤液,选用④、⑤和⑦
D. 检验滤液中的Fe3+,选用③、⑧和⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有42.4g由Fe、Al、Al2O3组成的混合物,将固体混合物分成两等份,将其中一份加入足量的NaOH溶液中充分反应后剩余固体质量为5.6g;将另一份完全溶解在600mL2mol/L的硫酸溶液中,收集到标准状况下的气体8.96 L,欲使该反应后溶液中的金属离子完全沉淀,至少应加入3mol/LNaOH溶液的体积是
A. 300mL B. 600mL C. 800mL D. 900mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象、解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 充分吸收了Na2SiO3 饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不燃烧 | Na2SiO3 可作防火剂 |
B | 将 H2 在充满Cl2 的集气瓶中燃烧 | 集气瓶口上方有白烟生成 | H2、Cl2 化合生成HCl |
C | 将 SO2 通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2 具有氧化性 |
D | 除去表面氧化膜的铝箔,在酒精灯上充分加热 | 铝不能滴落下来 | 铝熔点高,没能熔化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下面科普信息,回答问题:
一个体重50kg的健康人含铁2 g,这2g铁在人体中以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(1)在Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了______性,则56g Fe参加反应时,被还原的HNO3为____g。
(2)工业盐的主要成分是NaNO2,曾多次发生过因误食中毒的事件,其原因是NaNO2外观和食盐相似,又有咸味,却可以把人体内的Fe2+转化为Fe3+而失去了与O2结合的能力。(已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。)根据上述反应,可判断NaNO2具有 __________性。鉴别NaNO2和NaCl,可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋,你认为必须选用的物质有______(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是______。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式______Al+______NaNO3+______NaOH=______NaAlO2+______N2↑+______H2O;若反应过程中转移5mol电子,则生成标准状况下N2的体积为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体A是一种三原子分子,某学习小组按下列流程进行了实验:
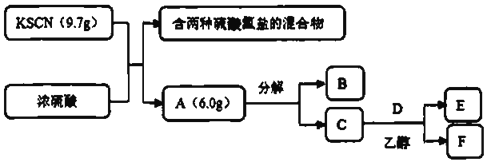
其中,将金属钠投入足量的无水乙醇,往反应液中通人![]() ,可制得D,C和D按
,可制得D,C和D按![]() 反应生成等物质的量的E和F.已知:B是一种常见的氧化物;C是一种淡黄色的固体单质;E在标准状况下的密度约为
反应生成等物质的量的E和F.已知:B是一种常见的氧化物;C是一种淡黄色的固体单质;E在标准状况下的密度约为![]() 。请回答:
。请回答:
(1)A的结构_______________,其空间构型为_______________。
(2)KSCN粉末与浓硫酸反应生成A的化学方程式_________________;为检验硫酸氢盐混合物中的![]() ,请写出实验操作和现象______________________________。
,请写出实验操作和现象______________________________。
(3)A不太稳定,容易分解,写出A分解为B和C的化学方程式________________________。
(4)①D的化学式________________。
②F的成键情况与![]() 相似,F的电子式________________。
相似,F的电子式________________。
③工业上常用电解熔融NaCl制Na,事实上电解许多熔融的钠的化合物也能制备Na,如NaOH.试写出电解熔融NaOH的化学方程:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究新的热点。 完成下列问题:
(1)CO2催化加氢合成CH3OCH3是一种CO2转化方法,其过程中主要发生下列反应:
反应I:![]()
反应Ⅱ:![]()
①写出CO和H2合成CH3OCH3的热化学方程式____。
②分别在2L恒温密闭容器甲(恒温恒容)、乙(恒温恒压)中,加入CO2和H2各1 mol的混合气体,假设只发生反应Ⅱ,则两容器中反应达平衡后放出或吸收的热量较多的是____(填“甲”或“乙”)。当反应5 min时,测得甲容器中压强变为原来的一半,则用CO2表示的反应的速率= ___。
③在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:
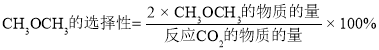
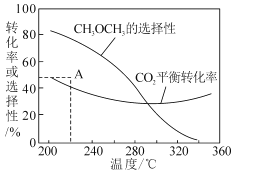
i)温度高于300℃,温度对CO2平衡转化率影响较大的是反应____(填“I”或“Ⅱ”)。
ii)220℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施可以是____(任答一条)。
(2)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为____(写离子符号);若所得溶液c(HCO3-):c(CO32-)=1:5,溶液pH= ___。(室温下,H2CO3的![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法,正确的是( )
A.由甲烷在纯氧中完全燃烧只生成CO2和H2O说明甲烷不含氧元素
B.![]() 最多有16个原子共平面
最多有16个原子共平面
C.油脂在人体内水解为氨基酸和甘油等小分子才能被吸收
D.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com