
| A. | 标准状况下,22.4 L NH3溶于水后溶液中含有NA个NH4+ | |
| B. | 1L 0.1 mol•L-1的Na2CO3溶液中含有0.2 NA个Na+ | |
| C. | 1 mol 硫酸钾中阴离子所带电荷数为NA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液中含有0.1NAFe3+ |
分析 A、氨气溶于水的反应为可逆反应;
B、求出碳酸钠的物质的量,然后根据1mol碳酸钠中含2mol钠离子来分析;
C、硫酸钾由2个钾离子和1个硫酸根构成;
D、铁离子是弱碱阳离子,在溶液中会水解.
解答 解:A、氨气溶于水的反应为可逆反应,不能完全反应生成一水合氨,且一水合氨为弱碱,不能彻底电离,故溶液中的铵根离子的个数小于NA个,故A错误;
B、溶液中碳酸钠的物质的量n=CV=0.1mol/L×1L=0.1mol,而1mol碳酸钠中含2mol钠离子,故0.1mol碳酸钠中含0.2NA个钠离子,故B正确;
C、硫酸钾由2个钾离子和1个硫酸根构成,故1mol硫酸钾中含1mol硫酸根,带2NA个电荷,故C错误;
D、铁离子是弱碱阳离子,在溶液中会水解,故溶液中的铁离子的个数小于0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
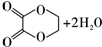 ,B的结构简式为OGC-CHO.
,B的结构简式为OGC-CHO.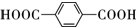
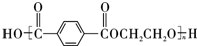 .
.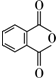 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾是一种常用的化学试剂,当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 | |
| B. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| C. | 油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度从而增大与氢氧化溶液的接触面积,从而加快油脂皂化反应速率 | |
| D. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗氧气的体积为1.68 L | |
| B. | 混合气体中含NO21.12 L | |
| C. | 此反应过程中转移的电子为0.3 mol | |
| D. | 参加反应的硝酸是0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 150 | 300 | 380 | 410 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com