
A.单位时间内生成2n mol A,同时生成n mol D
B.容器内压强不随时间而变化
C.单位时间内生成n mol B,同时消耗1.5n mol C
D.容器内混合气体密度不随时间而变化
科目:高中化学 来源: 题型:
| 容器 编号 |
温度 /℃ |
起始量/mol | 平衡量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||
| CO | H2O | CO2 | H2 | ||||
| ① | 650 | 1 | 2 | 0.4 | 0.4 | 5 | 16.4kJ |
| ② | 650 | 2 | 4 | t1 | Q1 kJ | ||
| ③ | 900 | 2 | 4 | 1.6 | 1.6 | t2 | Q2 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
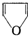 ,它的蒸气或者具有
,它的蒸气或者具有 结构的有机物的蒸气遇到用盐酸浸湿的松木片时发生显绿色的反应,叫做松片反应.
结构的有机物的蒸气遇到用盐酸浸湿的松木片时发生显绿色的反应,叫做松片反应. 互为同分异构体且具有松片反应的两种有机物的结构简式
互为同分异构体且具有松片反应的两种有机物的结构简式



 ,它用于塑料、清漆、医药和香烟香料.糠醛在NaOH溶液作用下发生自身氧化还原反应得到两种均含呋喃结构的有机物,它们的结构简式为
,它用于塑料、清漆、医药和香烟香料.糠醛在NaOH溶液作用下发生自身氧化还原反应得到两种均含呋喃结构的有机物,它们的结构简式为





查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所x需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
| 一定条件 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com