
| A. | x=5 | |
| B. | 每生成16 mol N2转移10 mol电子 | |
| C. | N2既是氧化产物又是还原产物 | |
| D. | 反应中氧化产物与还原产物的质量之比为1:15 |
分析 由质量守恒可知x=5,则方程式为10NaN3+2KNO3═K2O+5Na2O+16N2↑,反应中只有N元素的化合价变化,由N元素的化合价降低可知,2molKNO3反应转移电子为2mol×(5-0)=10mol,以此来解答.
解答 解:A.由质量守恒可知x=5,故A正确;
B.由反应可知,2molKNO3反应转移电子为2mol×(5-0)=10mol,即每生成16 mol N2转移10 mol电子,故B正确;
C.只有N元素的化合价变化,则N2既是氧化产物又是还原产物,故C正确;
D.该反应中10molNaN3是还原剂,生成氧化产物N2的物质的量是15mol;2molKNO3是氧化剂,生成还原产物N2的物质的量是1mol,反应中氧化产物与还原产物的质量之比为15:1,故D错误.
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Mg和Al | B. | Mg和Ag | C. | Na和Zn | D. | Fe和Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:解答题
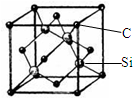 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
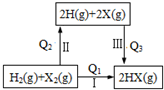
| A. | Q3>0 | B. | Q1=Q2+Q3 | ||
| C. | 按Cl、Br、I的顺序,Q2依次增大 | D. | Q1越大,HX越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别放在炒锅中加热,观察是否有残留物 | |
| B. | 分别用干净铁丝蘸取样品在燃气炉的火焰上灼烧,观察火焰颜色 | |
| C. | 在水杯中各盛少许相同质量的样品,分别加入足量的水,观察样品是否溶解 | |
| D. | 在水杯中各盛少许相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com