
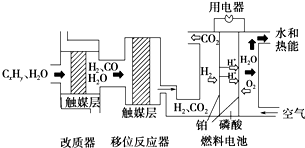
 磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如图所示.下列说法不正确的是( )
磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如图所示.下列说法不正确的是( )| A、该系统中只存在化学能和电能的相互转化 | ||
B、在移位反应器中,反应CO(g)+H2O(g)
| ||
| C、改质器和移位反应器的作用是将CxHy转化为H2和CO2 | ||
| D、该电池正极的电极反应为O2+4H++4e-=2H2O |


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| A、X元素的次外层上有18个电子 |
| B、Y元素的最外层上有2个电子 |
| C、Z元素形成的单核阳离子,具有稀有气体元素的核外电子排布 |
| D、R元素形成的单核阴离子,具有稀有气体元素的核外电子排布 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4HCO3溶液与过量NaOH溶液反应 NH4++OH-═NH3↑+H2O |
| B、过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O═HCO3-+HClO |
| C、向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+═CO2↑+H2O |
| D、向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、MnO2固体与浓盐酸反应制取Cl2:MnO2+4HCl
| ||||
| B、AlCl3溶液中滴加浓氨水至过量:Al3++4NH3?H2O═AlO2-+4NH4++2H2O | ||||
| C、氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | ||||
| D、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24LCO2中含有的原子数为0.3NA |
| B、0.1L3mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
| C、5.6g铁粉与硝酸反应失去的电子数一定为0.3NA |
| D、4.5gSiO2晶体中含有的硅氧键数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6个 | B、9个 |
| C、12个 | D、15个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选用试剂 | 实验现象 | |
| 第一种方法 | ||
| 第二种方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com