
| A. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 含有大量NH4+的溶液:Mg2+、S2-、OH-、I- | |
| C. | 通有足量NO2的溶液:K+、Na+、SO32-、AlO2- | |
| D. | 强酸性溶液中:Na+、Fe3+、NO3-、SO42- |
分析 A.强碱性溶液含大量的氢氧根离子;
B.离子之间结合生成沉淀、弱电解质;
C.通有足量NO2的溶液,具有酸性和强氧化性;
D.强酸性溶液中该组离子之间不反应.
解答 解:A.强碱性溶液含大量的氢氧根离子,不能大量存在Al3+,故A不选;
B.Mg2+、OH-结合生成沉淀,NH4+、OH-结合生成弱电解质.不能大量共存,故B不选;
C.通有足量NO2的溶液,具有酸性和强氧化性,与SO32-发生氧化还原反应,酸溶液中不能大量存在AlO2-,故C不选;
D.强酸性溶液中该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关系,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
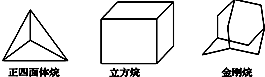
| A. | 2种,4种,8种 | B. | 2种,4种,6种 | C. | 1种,3种,6种 | D. | 1种,3种,8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将样品配制成溶液V1L,取其中25.00mL恰好与V2mL浓度为cmol/L酸性KMnO4溶液完全反应 | |
| B. | 向样品中加足量H2O2,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg | |
| C. | 将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g | |
| D. | 将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO3的洗气瓶、盛有浓H2SO4的洗气瓶、盛有碱石灰的干燥管Ⅰ、盛有碱石灰的干燥管Ⅱ,测定干燥管Ⅰ增重d g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
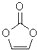
| A. | 1mol该物质最多可与2molH2加成 | B. | 分子式为C3H2O3 | ||
| C. | 分子中只有极性键 | D. | 8.6g该物质完全燃烧得到6.72LCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的物质的量 | B. | 混合气体的密度 | ||
| C. | 混合气体的平均相对分子质量 | D. | 固体A的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
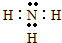
 ,其中含有的化学键有共价键、离子键,属于离子 晶体
,其中含有的化学键有共价键、离子键,属于离子 晶体查看答案和解析>>
科目:高中化学 来源: 题型:实验题
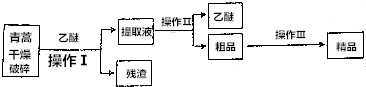
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1mol•L-1的CH3COOH溶液中,由水电离出的c(H+)为1.0×10-13mol•L-1 | |
| B. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| C. | 常温下,等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液的pH<7 | |
| D. | 25℃时,完全中和50mLpH=3的H2SO4溶液,需要pH=11的NaOH溶液50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O)
甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4-+5H2C2O4+6H+=2Mn2++10CO2+8H2O)| 序号 | A溶液 | B溶液 |
| ① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
| ③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/ml | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com