
 酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
分析 1)①根据量热计的构造来判断该装置的缺少仪器;
②中和热测定实验成败的关键是保温工作;
③醋酸是弱酸,电离过程吸热;
(2)①根据碱性溶液只能存放在碱式滴定管中;
③选择酚酞,观察到锥形瓶中溶液的颜色由无色变为浅红色,且半分钟不褪色,则达到滴定终点;
④先根据数据的有效性,舍去第3组数据,然后求出1、2组平均消耗V(NaOH),接着根据c(待测)=计算;
解答 (1)①根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,
故答案为:环形玻璃搅拌器;
②中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热、减少实验过程中的热量散失,
故答案为:保温、隔热、减少实验过程中的热量散失;
③醋酸是弱酸,电离过程吸热,所以用用醋酸代替上述盐酸实验,测得反应前后温度的变化值会减小,中和热偏大,数值偏小,
故答案为:偏低;
(2)①标准NaOH溶液只能存放在碱式滴定管中,
故答案为:b;
③选择酚酞,观察到锥形瓶中溶液的颜色由无色变为浅红色,且半分钟不褪色,则达到滴定终点,
故答案为:观察到锥形瓶中溶液的颜色由无色变为浅红色,且半分钟不褪色;
④三次滴定消耗的体积为:24.02mL,23.96mL,22.52mL,舍去第3组数据,然后求出1、2组平均消耗V(NaOH)=23.99mL,c(待测)===0.096mol/L,
故答案为:0.096mol/L.
点评 本题主要考查中和热测定、酸碱中和滴定,明确实验的原理、步骤、注意事项、数据处理等即可解答,题目难度中等.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
| A. | 在pH=1溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 在含有大量[Al(OH)4]-溶液中:NH4+、Na+、Cl-、H+ | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在强碱溶液中:Na+、K+、CO32-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol•L-1 | |
| B. | 18gH2O在标准状况下的体积是22.4L | |
| C. | 22.4LO2中一定含有6.02×1023个氧分子 | |
| D. | 在标准状况时,20mLNH3与60mLNO所含的原子个数比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol/L CH3COONa溶液显碱性 | |
| B. | 0.1 mol/L醋酸溶液的pH=3 | |
| C. | 物质的量浓度相同的盐酸和醋酸同时与锌反应,开始时锌粒跟盐酸反应比跟醋酸反应的速率快 | |
| D. | 中和100 ml 1 mol/L 的CH3COOH溶液需要100 ml 1 mol/L的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③⑤ | C. | ③④ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制乙酸乙酯时,不断的蒸出乙酸乙酯来提高产率 | |
| B. | CO有毒,会与血液中血红蛋白(用Hb表示)化合发生下述反应:CO+HbO2?HbCO+O2,输氧抢救CO中毒的患者 | |
| C. | 皂化反应采用强碱性条件,促使油脂水解 | |
| D. | 合成氨时,采用高温与高压来提高氨气的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 1mol•L-1MnSO4溶液 | 反应温度/℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | 2mL | 1mL | 1mL | 0 | 20 | 320 |
| Ⅲ | 2mL | 2mL | mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
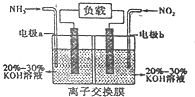
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HI体积分数 | 1min | 2min | 3min | 4min | 5min | 6min | 7min |
| 条件I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
| 条件II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
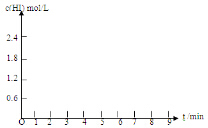
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
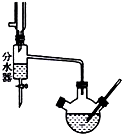 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com