
| A. | 氢氧化镁中滴加盐酸:H++OH-═H2O | |
| B. | 碳酸氢钙溶液与稀硝酸反应:Ca(HCO3)2+2H+=Ca2++CO2↑+H2O | |
| C. | 金属铝溶于氢氧化钠溶液:2Al+6OH-═2AlO2-+3H2↑ | |
| D. | 用FeCl3溶液腐蚀铜电路板:2Fe3++Cu═2Fe2++Cu2+ |
分析 A.氢氧化镁为难溶物,离子方程式中氢氧化镁不能拆开;
B.碳酸氢钙为易溶物,离子方程式中需要拆开;
C.离子方程式两边负电荷不相等,违反了电荷守恒;
D.氯化铁与铜反应生成氯化铜和氯化亚铁.
解答 解:A.氢氧化镁与稀硫酸反应的离子反应为:2H++Mg(OH)2═2H2O+Mg2+,故A错误;
B.碳酸氢钙溶液中加入稀硝酸的离子反应为:HCO3-+H+═H2O+CO2↑,故B错误;
C.金属铝溶于氢氧化钠溶液反应的离子方程式为:2Al+2H2O+2OH-═2AlO2-+3H2↑,故C错误;
D.用FeCl3溶液腐蚀铜电路板,反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,故D正确;
故选D.
点评 本题考查离子反应书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的考查,题目难度不大.


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| A. | 露置在空气中,容器内酸液的质量都减轻 | |
| B. | 浓硫酸可与铜反应制氢气 | |
| C. | 常温下铁与浓硝酸反应,产生大量的红棕色气体 | |
| D. | 浓硫酸和浓硝酸在常温下都能用铝制容器盛放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
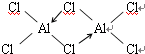 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 李比希燃烧法、钠熔法、铜丝燃烧法都是用来分析有机物元素组成的方法 | |
| B. | 红外光谱法、紫外光谱法、核磁共振、质谱仪等都是现代化学测定有机物结构的常用方法 | |
| C. | 同位素示踪法是研究化学反应历程的手段之一 | |
| D. | CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR 谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR 来鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ①②④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 依据“溶液中的离子平衡”相关化学知识,回答下列问题.
依据“溶液中的离子平衡”相关化学知识,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com