
| A. | 氢氧燃枓电池、铅蓄电池、硅太阳能电池都利用了原电池原理 | |
| B. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| C. | 为防止重金属等污染土壤和水体,废电池应回收综合利用 | |
| D. | 用可降解的“玉米塑料”制作一次性饭盒,能减少“白色污染” |
分析 A.太阳能电池应用的是光电效应;
B.机动车尾气含有氮的氧化物能形成光化学烟雾;
C.电池中的重金属等污染土壤和水体,应回收处理,并积极开发废电池的综合利用技术;
D.根据“白色污染”是指塑料污染解答.
解答 解:A.太阳能电池应用的是光电效应不是原电池原理,故A错误;
B.机动车尾气含有氮的氧化物能形成光化学烟雾,新能源汽车的推广,减少了氮的氧化物,有助于减少光化学烟雾的产生,故B正确;
C.因电池中的重金属等污染土壤和水体,应回收处理,并积极开发废电池的综合利用技术,故C正确;
D.根据“白色污染”是指塑料污染,用可降解的“玉米塑料”制作一次性饭盒,能减少“白色污染,故D正确;
故选A.
点评 本题考查物质的性质、用途的关系,明确物质的性质是解答的关键,注意性质决定物质的用途,并把握化学与生活的联系,题目难度不大.


科目:高中化学 来源: 题型:解答题
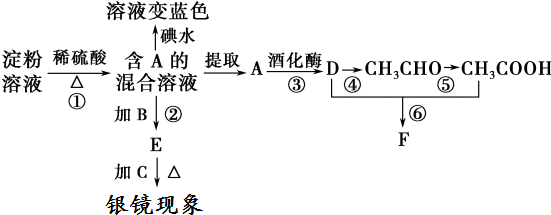
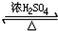 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们均位于元素周期表有前四周期,A与B位于不同周期且B元素的原子含有3个能级,B元素原子的每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们均位于元素周期表有前四周期,A与B位于不同周期且B元素的原子含有3个能级,B元素原子的每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol丙烯中含有共价键的数目为0.6NA | |
| B. | 0.1mo Cl2全部溶于水后转移电子的数目为0.1NA | |
| C. | 标准状况下,2.24LSO3中含有氧原子的数目为0.3NA | |
| D. | 9.2g由乙醇和二甲醚(CH3OCH3)组成的混合物中含有氧原子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
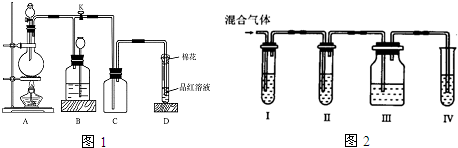
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
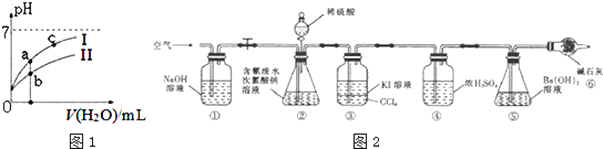
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯醛的结构简式:CH2═CHCHO | |
| B. | CSO的电子式: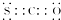 | |
| C. | 硫酸氢钠熔融时的电离方程式:NaHSO4═Na++HSO4- | |
| D. | S2-的结构示意图: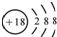 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
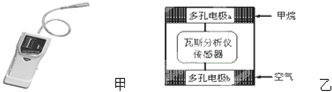
| A. | 电极b是正极,O2-由电极a流向电极b | |
| B. | 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a | |
| C. | 当固体电解质中有1 mol O2-通过时,电子转移4 mol | |
| D. | 电极a的反应式为:CH4+5O2--8e-═CO32-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com