
| A. | 钠和铁一样,都能在氯气中燃烧生成金属氯化物 | |
| B. | 氯水具有杀菌、漂白作用是因为氯水中含有强氧化性的次氯酸 | |
| C. | 氯气跟变价金属反应生成高价金属氯化物 | |
| D. | 液氯是氯气的水溶液,它能使干燥的有色布条褪色 |
分析 A.氯气具有强氧化性,能和金属元素在点燃条件下反应生成氯化物;
B.氯气和水反应生成HClO,HClO具有强氧化性;
C.氯气具有强氧化性,能和变价金属反应生成高价金属氯化物;
D.液氯是氯气的液态,氯气不能使干燥的有色布条褪色.
解答 解:A.氯气具有强氧化性,能和金属元素在点燃条件下反应生成氯化物,所以钠和铁一样,都能在氯气中燃烧生成金属氯化物,故A正确;
B.氯气和水反应生成HClO,HClO具有强氧化性,能使病毒变性而杀菌消毒、使有色物质褪色,故B正确;
C.氯气具有强氧化性,能和变价金属反应生成高价金属氯化物,如:铁在氯气中燃烧,无论氯气是否过量都只生成氯化铁,故C正确;
D.液氯是氯气的液态,氯气不能使干燥的有色布条褪色,氯气和水反应生成的HClO能使有色布条褪色,故D错误;
故选D.
点评 本题考查氯气性质,熟悉氯气的强氧化性、次氯酸的漂白性,注意次氯酸漂白性和二氧化硫漂白性的区别,知道液氯和氯水的关系,易错选项是D.


科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应可以设计成原电池来提供电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=14的溶液中:K+、NH4+、NO3-、HCO3- | |
| B. | 能使甲基橙变红的溶液中:Na+、K+、SO42-、AlO2- | |
| C. | 0.1mol•L-1Fe(NO3)2溶液中:H+、Ca2+、SCN-、Cl- | |
| D. | 0.1mol•L-1AlCl3溶液中:Cu2+、Mg2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 | |
| B. | CO会与血红蛋白结合,使人中毒;可将中毒病人放入氧仓中解毒,其解毒原理符合平衡移动原理 | |
| C. | 2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物 | |
| D. | 固体煤经处理变为气体燃料后,可以减少SO2和烟尘的排放,且燃烧效率提高,有利于“节能减排” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用碱石灰吸收SO2 | B. | CO2与澄清石灰水作用 | ||
| C. | N2O5与水反应制备HNO3 | D. | Na2O2与水反应制备氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
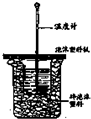 用如图实数装置进行中加热测定实验,请回答下列问题:
用如图实数装置进行中加热测定实验,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com