
分析 (1)由2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2、2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,可知10L混合气体反应消耗7.5L氧气,故氧气有剩余,设CO气体的xL,则甲烷为(10-x)L,利用方程式根据差量法表示出体积变化量,再根据剩余的气体的体积列方程计算混合物中各气体的体积;
(2)根据(1)中的关系式计算CO、甲烷的体积;
(3)由(1)中的关系式计算a的表达式,结合0<x<10计算.
解答 解:(1)由2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2、2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,可知10L混合气体反应消耗7.5L氧气,故氧气有剩余,
设V(CO)为xL,V(H2)为(10-x)L,则:
2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,△V
2 1 2 1
x 0.5x
2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,△V
2 1 3
(10-x) 1.5(10-x)
则0.5x+1.5(10-x)=15+10-15,解得x=5,
即V(CO)=5L,则V(H2)=(10-x)L=10L-5L=5L,
故答案为:5;5;
(2)由(1)可得:0.5x+1.5(10-x)=15+10-a,
解得x=(a-10)L,V(H2)=(10-x)L=(20-a)L,
即 V(CO):V(H2)=(a-10):(20-a)
故答案为:(a-10);(a-10):(20-a);
(3)由(1)可得:0.5x+1.5(10-x)=15+10-a,
解得:a=10+x,
因0<x<10,则10<a<20,
故答案为:10<a<20.
点评 本题混合物的有关计算,侧重于学生的分析能力和计算能力的考查,注意差量法的利用,明确反应前后体积的变化及该条件下水的状态是关键,学生容易忽略水在常温下为液体而导致分析错误.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2S | B. | CuSO4 | C. | NaCl | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
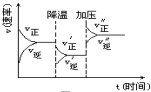 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 逆反应是放热反应 | B. | 正反应是放热反应 | ||
| C. | 若A、B是气体,则D一定是气体 | D. | A、B、C、D均为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +3 | C. | +6 | D. | +7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2(CuO):HCl | B. | MgO(Al2O3):NaOH溶液 | ||
| C. | Na2SiO3溶液(Na2CO3):过量的CO2 | D. | CO2(HCl):饱和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com