
【题目】肉桂酸( )主要用于香精香料、食品添加剂、有机合成等方面,它的合成原理为
)主要用于香精香料、食品添加剂、有机合成等方面,它的合成原理为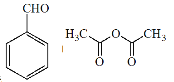
![]()
 +CH3COOH
+CH3COOH
主要试剂及其物理性质:
名称 | 相对分 子质量 | 性状 | 密度/ (g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解度/(g/100 mL溶剂) | ||
水 | 醇 | 醚 | ||||||
苯甲醛 | 106 | 无色 液体 | 1.044 | -26 | 178~179 | 微溶 | 溶 | 溶 |
乙酸酐 | 102 | 无色 液体 | 1.082 | -73 | 138~140 | 反应 | 溶 | 难溶 |
肉桂酸 | 148 | 白色 粉末 | 1.248 | 133~134 | 300 | 微溶 | 溶 | 溶 |
试剂用量:
试剂名称 | 苯甲醛 | 乙酸酐 | 无水碳酸钾 | 10%氢氧化钠 | 浓盐酸 | 活性炭 |
试剂用量 | 3.0 mL | 5.5 mL | 4~5 g | 40 mL | 25 mL | 1.0 g |
实验仪器如下:
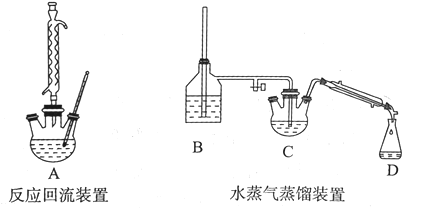
请回答下列问题:
(1)实验准备阶段:在组装实验仪器前要确保反应回流装置彻底干燥,其原因是:_______。
(2)将3.0 mL苯甲醛、5.5 mL乙酸酐和4.00 g无水碳酸钾依次加人250 mL三颈烧瓶中摇匀,烧瓶底部有白色颗粒状固体生成,上部液体无色透明,反应剧烈,有白烟冒出。搭建好回流装置后,开始加热回流。加热回流时控制反应呈微沸状态,加热温度不能太高的原因:_____。
(3)实验结束后,向三颈烧瓶中加人40 mL 10%的氢氧化钠溶液和20 mL的水,可观察到母液体系分为油相和水相。将装置改为水蒸气蒸馏装置,开始加热蒸馏,使油相中的苯甲醛随水蒸气离开母液,开始收集。加人NaOH的作用是:__________。B装置中的长玻璃导管的作用是:_______。水蒸气蒸馏装置中需要加热的仪器有____(填装置序号)。
(4)对蒸气发生器进行加热,待蒸气稳定后再通人烧瓶中的液面下,开始蒸气蒸馏,待检测馏出物中无油滴后停止蒸馏。加人1.0 g活性炭脱色,热过滤。活性炭脱色的原理是______。
(5)加入25 mL的浓盐酸,冰水浴,烧杯中有白色颗粒出现。抽滤(用冰水洗涤),烘箱干燥,称量。称重得m=0.35 g。则该反应的产率约为_____(结果精确至0.1% )。
【答案】防止乙酸酐与水反应而变质 防止乙酸酐(和苯甲醛)挥发(2分,苯甲醛不写给分) 将肉桂酸转化为肉桂酸钠,便于分离 调节体系和大气压强,判断水蒸气蒸馏系统是否畅通 B、C 吸附 8.0 %
【解析】
(1) (2) 由题中所给试剂及其物理性质,可推导出答案;(4)考活性炭脱色的原理;(3) NaOH是为了将肉桂酸转化为肉桂酸钠,B装置中的长玻璃导管也叫安全管,据此作答;(5)先根据表中密度计算出苯甲醛、乙酸酐的质量,再计算出它们的物质的量,然后理论上生成肉桂酸的质量,最后计算出肉桂酸的产率。
(1)由题中所给试剂及其物理性质可知乙酸酐会与水反应,故准备实验时要将反应回流装置彻底干燥,故答案为:防止乙酸酐与水反应而变质;
(2)结合题干信息可知乙酸酐的沸点较低,因此加热回流时,应控制反应呈微沸状态,以防止乙酸酐挥发而影响产量,故答案为:防止乙酸酐(和苯甲醛)挥发;
(3)由分析可知,加入NaOH是为了将肉桂酸转化为肉桂酸钠,便于分离。答案:将肉桂酸转化为肉桂酸钠,便于分离;B装置中的长玻璃导管也叫安全管,如果体系内压强增大,水会沿导管上升,起到调节压强的作用,即可通过观察导管内液面来判断水蒸气蒸馏系统是否畅通。答案:调节体系和大气压强,判断水蒸气蒸馏系统是否畅通;B为产生水蒸气的装置,C为蒸馏装置,故B、C处都需要加热,故答案为:B、C;
(4)活性炭脱色是利用它的吸附性,故答案为:吸附;
(5)由反应已知的实验原理可知,肉桂酸的理论产量为![]() ,则其实际产率
,则其实际产率![]() ,故答案为:8.0 %
,故答案为:8.0 %


科目:高中化学 来源: 题型:
【题目】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图所示:
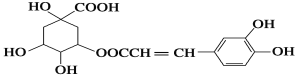
关于咖啡鞣酸的下列叙述正确的是( )
A.分子式为C16H13O9
B.1 mol咖啡鞣酸可与含8 mol NaOH的溶液反应
C.能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键
D.与浓溴水能发生两种类型的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的反应:2SO2(g) + O2(g) ![]() 2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是
2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是
A. 正、逆反应速率都等于零 B. SO2、O2、SO3的浓度相等
C. SO2、O2、SO3在容器中共存 D. SO2、O2、SO3的浓度均不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1 mol/L 的盐酸滴定相同浓度的25 mL溴化肼(N2H5Br)溶液,已知肼(N2H4)是二元弱碱,N2H4+H2O ![]() N2H5+ + OH- Kb1 = 1.0 × 10-6,N2H5+ + H2O
N2H5+ + OH- Kb1 = 1.0 × 10-6,N2H5+ + H2O ![]() N2H62+ + OH- Kb2 = 1.3 × 10-15,滴定过程中混合溶液的相对导电能力变化曲线如图所示。下列叙述错误的是( )
N2H62+ + OH- Kb2 = 1.3 × 10-15,滴定过程中混合溶液的相对导电能力变化曲线如图所示。下列叙述错误的是( )

A.N2H4与硫酸反应形成的酸式盐的化学式为N2H6(HSO4)2
B.b点表示盐酸与溴化肼恰好完全反应:c(Cl-)=c(Br-)>c(N2H62+)
C.a点对应的溶液中:c(Br-)+c(OH-) ═ c(N2H5+)+2c(N2H62+)+c(H+)
D.c点的混合溶液中:c(Cl-)>c(Br-)>c(H+)>c(N2H62+)>c(N2H5+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,请回答下列问题:
(1)准确称量5.0 g含有少量易溶杂质的样品(杂质不与盐酸反应),配成250 mL待测溶液,用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、___________________。
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,量取待测液10.00 mL应选用_________仪器(填字母)。
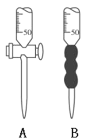
(3)滴定过程中,眼睛应注视___________________________________,以甲基橙做指示剂,正确判断滴定终点的现象是________________________________。
(4)由下表可知,第2次所用盐酸体积明显偏大,其可能的原因是_________。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 2.10 | 24.20 |
第三次 | 10.00 | 4.10 | 24.00 |
a.锥形瓶用待测液润洗
b.滴定过程中锥形瓶中溶液溅出瓶外
c.滴定前滴定管尖嘴有气泡,滴定结束气泡消失
d.滴定结束时,俯视读数
(5)根据表中数据,计算被测烧碱溶液的物质的量浓度是_________,烧碱样品的纯度是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(MnS)=2.5×10-13,Ksp(FeS)=6.3×10-18。FeS和MnS在水中的沉淀溶解平衡曲线如图所示(X2+表示Fe2+或Mn2+),下列说法错误的是( )
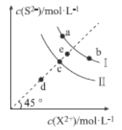
A.曲线I表示MnS的沉淀溶解平衡曲线
B.升高温度,曲线Ⅱ上的c点可沿虚线平移至d点
C.常温下,反应MnS(s)+Fe2+(aq)![]() FeS(s)+Mn2+(aq)的平衡常数K≈4×104
FeS(s)+Mn2+(aq)的平衡常数K≈4×104
D.向b点溶液中加入少量Na2S固体,溶液组成由b点沿工线向a点方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银由于其优良的性能和特性被广泛应用于照相、电子、电气等工业。废定影液中银主要以Na3Ag(S2O3)2形式存在,实验室用废定影液制备Ag的具体流程如图所示:
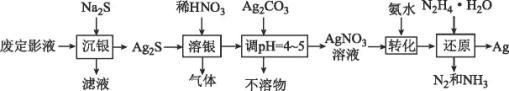
注:“还原”时由于Ag+直接与N2H4H2O反应过于激烈,所以采用加入氨水,使Ag+与氨形成[Ag(NH3)2]+,降低Ag+的浓度,从而相应降低Ag+的氧化能力,使反应能够平稳进行。
回答下列问题:
(1)“溶银”时产生的气体是___(填化学式)。
(2)N2H4H2O(水合肼)为无色透明的油状发烟液体,具有强还原性,实验室制备原理为NaClO+2NH3=N2H4H2O+NaCl,可能用到的实验装置如图所示:
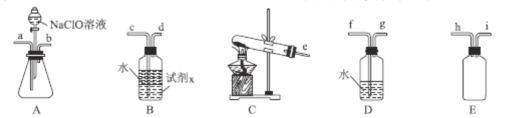
①本实验中用不到的装置是___。(填字母),试剂x是___(填化学式,任写一种)。
②加入NaClO溶液时要慢慢滴加,目的是___。
③按气流从左到右的方向,整套装置的连接顺序为___(填仪器接口小写字母)。
(3)AgNO3见光或受热易分解。将上述流程中AgNO3溶液蒸发浓缩可获得AgNO3固体,实验装置如图所示:

①使用真空泵的目的是___。
②测定AgNO3固体的纯度(杂质不参与反应)称取2.00g制备的AgNO3固体,加水溶解,定容到100mL;准确量取25.00mL溶液,酸化后滴入几滴NH4Fe(SO4)2溶液作指示剂,再用0.1000molL-1NH4SCN标准溶液滴定,消耗NH4SCN标准溶液的平均体积为29.00mL,则固体中AgNO3的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
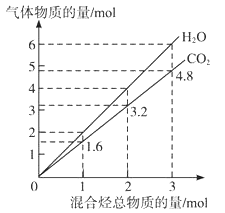
①一定有乙烯 ②一定有甲烷 ③一定有丙烷
④一定没有乙烷 ⑤可能有甲烷 ⑥可能有乙炔
A. ②⑤⑥ B. ②⑥ C. ②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )。
A.将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)→C(金刚石) ΔH=+119kJ·mol·L-1 ”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.31 kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与1mol NaOH溶液混合,放出的热量大于57.3 kJ
D.在101kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH =+285.8 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com