


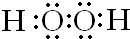 ,C元素是O元素,O元素在周期表中的位置是第二周期第VIIA族,
,C元素是O元素,O元素在周期表中的位置是第二周期第VIIA族,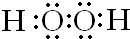 ;第二周期、第ⅦA族;
;第二周期、第ⅦA族;| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 8 |
| ||
| a3 |
| ||
| b3 |


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
| A、Ba(OH)2?8H2O与NH4Cl的反应 |
| B、铝片与稀硫酸反应 |
| C、甲烷在空气中燃烧 |
| D、灼热的焦炭与CO2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、环境污染主要指大气污染、水源污染、土壤污染、食品污染及噪声等 |
| B、大气污染主要指CO、SO2、NmOn、CmHn及粉尘等 |
| C、大气中CO2浓度增大,是造成酸雨的主要原因 |
| D、从保护环境考虑,未来最理想的燃料是氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀时的pH | 7.0 | 1.9 | 3.4 |
| 沉淀完全时的pH | 9.0 | 3.2 | 4.7 |
| 实验操作 | 现象 | 结论 |
| 取适量产品于洁净烧杯中,加入适量蒸馏 | 得黄棕色溶液 | |
| 水,充分搅拌,静置,滤去沉淀. | ||
| 溶液中不含Fe2+ | ||
| 溶液中含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为某原电池示意图,下列说法正确的是( )
如图为某原电池示意图,下列说法正确的是( )| A、电子沿导线流入铜电极 |
| B、锌原子失去电子变成Zn2+进入溶液 |
| C、原电池是电能转化为化学能的装置 |
| D、锌电极上发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com