
【题目】安全气囊是行车安全的重要设施。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客。为研究安全气囊工作的化学原理,取安全装置中的粉末进行研究。经实验分析,确定该粉末是一种混合物且只含Na、Fe、N、O四种元素。
(1)氧元素在元素周期表中的位置是__________________,Na原子结构示意图为_____________,其中三种主族元素的离子半径从大到小的顺序是___________________(用离子符号表示)。
(2)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐晶体中含有的化学键类型是____________________。
(3)水溶性实验表明,安全气囊中固体粉末部分溶解,不溶物为一种红棕色固体,可溶于盐酸,写出反应的化学方程式_______________________________________________。
【答案】 第二周期第ⅥA族 ![]() N3->O2->Na+ 离子键、共价键 Fe2O3+6HCl===2FeCl3+3H2O
N3->O2->Na+ 离子键、共价键 Fe2O3+6HCl===2FeCl3+3H2O
【解析】(1)氧原子有2个电子层,最外层电子数为6,处于周期表中第二周期第ⅥA族;
Na元素原子核外有11个电子,有3个电子层,由里到外各层电子数依次为2、8、1,原子结构示意图为![]() ;N3-、O2-、Na+电子层结构相同,核电荷数越大离子半径越小,故离子半径N3->O2->Na+;
;N3-、O2-、Na+电子层结构相同,核电荷数越大离子半径越小,故离子半径N3->O2->Na+;
(2)氮的最高价氧化物对应的水化物与其氢化物反应生成一种盐,该盐为NH4NO3,含有离子键、共价键;
(3)不溶物为一种红棕色固体,可溶于盐酸,该不溶物能发生铝热反应,则红棕色不溶物为氧化铁,氧化铁与稀盐酸发生反应生成氯化铁和水的反应方程式为Fe2O3+6HCl===2FeCl3+3H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1molL-1盐酸溶液中逐滴加入等浓度的氨水溶液,溶液中pH与pOH(pOH=一lgc(OH-))的变化关系如图所示。下列说法正确的是

A.b点消耗氨水的体积为20mL
B.PH>7时,溶液中都一定有:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.a点和c点所示溶液中水所电离出的c(OH-)分别为10-9molL-1和10-5molL-1
D.ab段所示溶液中相关离子浓度关系可能为:c(NH4+)>c(Cl-)>C(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某溶液中仅存在Na+、Fe3+、SO42-三种离子,已知Na+和SO42-个数比为3:2,则Na+、Fe3+和SO42-三种离子的个数比为( )
A.6:1:9 B.3:1:2 C.1:1:1 D. 9:1:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的短周期主族元素,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质在不同条件下反应可生成不同的物质甲和乙,其中甲是一种淡黄色的固体,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为_____,C为________。(填元素名称)
(2)A与B形成的一种化合物与甲反应的化学方程式为______________________________。
(3)A、B两元素形成的化合物属____________(填“离子”或“共价”)化合物。
(4)D的最高价氧化物对应的水化物和A的单质反应的化学方程式为____________________
(5)写出物质甲的电子式__________________,用电子式表示物质乙的形成过程:__________________________________________________。
(6)E的最高价氧化物的化学式为______________。
(7)写出C、E最高价氧化物的水化物反应的离子方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CaSO4[Ksp(CaSO4)=9×10-6] 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.在任何溶液中,c(Ca2+)·c(SO42-)均相等
B.d点溶液通过蒸发可以变到c点
C.b点对应的Ksp大于a点对应的Ksp
D.b点将有沉淀生成,平衡后溶液中c(SO42-)一定小于3×10-3 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A. C6H14与液溴在光照下会反应
B. 目前石油裂解是生产乙烯的主要方法
C. 苯的结构决定了苯的化学性质是易取代难加成
D. 乙烯、乙炔可通入溴水加以鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=__________,该反应为______反应(填吸热或放热)。[
若改变条件使平衡向正反应方向移动,则平衡常数_________(填序号)
①一定不变②一定减小③可能增大④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是___________。
(a)容器中压强不变(b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O)(d)c(CO)=c(CO2)
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃[ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 1000 | 1 | 2 | c | d | t |
①实验B中平衡时H2O(g)的物质的量是。
②通过计算可知,CO的转化率实验A实验B(填“大于”、“等于”或“小于”)。
③若实验C中达到平衡所需时间t3(填“大于”、“等于”或“小于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
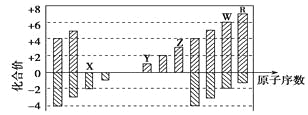
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R<W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学式所表示的有机化合物,核磁共振氢谱一定有三个峰的是
A. C2H6O B. C3H6
C. C3H7Cl D. C3H6O(能发生银镜反应)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com