
【题目】以下实验操作及现象均正确的是![]()
A. 实验Ⅰ:产生红褐色沉淀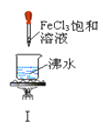
B. 实验Ⅱ:溶液颜色变红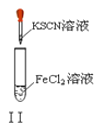
C. 实验Ⅲ:放出大量气体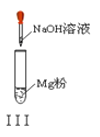
D. 实验Ⅳ:先出现白色沉淀,后溶解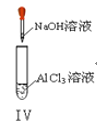
科目:高中化学 来源: 题型:
【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是
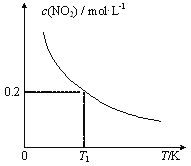
A. 若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数小于40%
B. 该反应的ΔH>0
C. T1时,该反应的平衡常数为![]()
D. 容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质或应用的说法正确的是( )
A.晶体硅是半导体,故在通信工程中用于制光导纤维
B.氧化镁的熔点高,可作优质的耐高温材料
C.液氨汽化放出大量的热,可用作制冷剂
D.明矾具有强氧化性,常用于自来水的杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应)。
【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在。
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计。
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化。
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格)。
实验序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
③ | ________ | 7 | 60 | ______ | ______ | 10 |
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示。
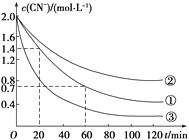
(2)实验①中20~60 min时间段反应速率:v(CN-)=______mol·L-1·min-1。
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是____________________(填一点即可)。在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO,同时放出NH3,试写出该反应的离子方程式:____________。
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他们设计实验并验证上述结论,完成下表中内容(已知:废水中的CN-浓度可用离子色谱仪测定) ______。
实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)甲醇熔融碳酸盐电池是一种新型燃料电池,该电池以熔融的Na2CO3为电解质,写出该电池负极的电极反应式:_____________________________
(2)恒容条件下,能表明反应I达到化学平衡状态的是________。
a.混合气体的密度不变 b.反应容器中甲醇的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)反应Ⅱ的△H2=__________。
(4)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,温度为500℃时,该反应10 min时达到平衡,CO2的平衡转化率为60℅,用H2表示该反应的速率为____________。
(5)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。
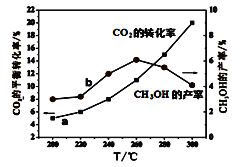
据图可知当温度高于260℃后,CO的浓度随着温度的升高而_________(填“增大”、“减小”、“不变”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答以下有关细胞物质组成和功能的问题:
(1)水是活细胞和生物体中含量最多的化合物,人体中水的含量约占65%,下列选项中能正确说明水对人体重要性的是______________________。
①水和糖类、脂肪、蛋白质一样,能为人体提供能量
②没有水人体内大部分化学反应就根本不会发生
③水的比热小,有利于维持体温
④体内营养物质的运输离不开水
⑤水在人体组织器官中也可以结合水的形式存在
(2)糖类不仅是生物体生命活动的主要能源物质,还有许多重要作用,如下图:
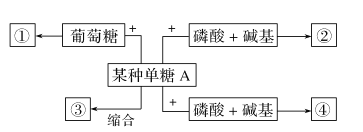
如果某种单糖A与葡萄糖缩合失去1分子水后形成的物质①遇斐林试剂不产生砖红色沉淀,则某种单糖A是________________。
如果某种单糖A缩合反应形成的物质③作为植物细胞壁的主要组成成分,则物质③是____________;如果某种单糖A与磷酸和碱基结合形成物质②,其中碱基是尿嘧啶,则形成的物质②是__________________;这说明糖类是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是( )
A. 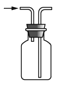 收集 NOB.
收集 NOB.  制备 NH3
制备 NH3
C. 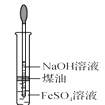 制备 Fe(OH)2D.
制备 Fe(OH)2D.  稀释浓 H2SO4
稀释浓 H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下能实现的是
①Al2O3![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
②S![]() SO3
SO3![]() H2SO4
H2SO4
③饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
④Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO
A. ①③⑤ B. ②③④ C. ②④⑤ D. ①④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com