
【题目】某溶液X中可能含有下列离子中的若干种:Cl-、![]() 、
、![]() 、
、![]() 、Na+、Mg2+、Fe3+,为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验(必要时可加热),下列说法不正确的是
、Na+、Mg2+、Fe3+,为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验(必要时可加热),下列说法不正确的是
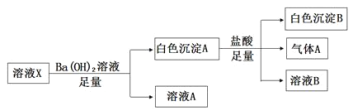
A.气体A可能是CO2或SO2
B.溶液X中一定存在![]()
C.溶液X中一定不存在Fe3+和Mg2+,可能存在Na+
D.向溶液A加入硝酸酸化的硝酸银溶液可能生成白色沉淀
【答案】C
【解析】
溶液与Ba(OH)2反应生成白色沉淀,则一定不含Fe3+,且产生的白色沉淀与足量盐酸反应,沉淀部分溶解且产生气体,则白色沉淀一定有BaSO4,一定存在SO42-、HCO3-或SO32-中的至少一种,气体为CO2或SO2:①若气体A是CO2,则溶液中一定存在SO42-、HCO3-,可能还含有Cl-、Na+、Mg2+(Na+、Mg2+至少存在一种);②若气体A是SO2,则溶液中一定存在SO42-、SO32-,由于SO32-和Mg2+不共存,则溶液中一定存在SO42-、SO32-、Na+,可能还含有Cl-,一定不存在Mg2+、HCO3-;③若气体A是CO2、SO2的混合气体,则溶液中一定存在SO42-、SO32-、HCO3-、Na+,可能还含有Cl-,一定不存在Mg2+,据此分析解答。
溶液与Ba(OH)2反应生成白色沉淀,则一定不含Fe3+,且产生的白色沉淀与足量盐酸反应,沉淀部分溶解且产生气体,则白色沉淀一定有BaSO4,一定存在SO42-、HCO3-或SO32-中的至少一种,气体为CO2或SO2:①若气体A是CO2,则溶液中一定存在SO42-、HCO3-,可能还含有Cl-、Na+、Mg2+(Na+、Mg2+至少存在一种);②若气体A是SO2,则溶液中一定存在SO42-、SO32-,由于SO32-和Mg2+不共存,则溶液中一定存在SO42-、SO32-、Na+,可能还含有Cl-,一定不存在Mg2+、HCO3-;③若气体A是CO2、SO2的混合气体,则溶液中一定存在SO42-、SO32-、HCO3-、Na+,可能还含有Cl-,一定不存在Mg2+;
A.溶液与Ba(OH)2反应生成白色沉淀,白色沉淀与足量盐酸反应,沉淀部分溶解且产生气体,则白色沉淀为BaSO4、BaSO3或BaCO3的混合物,气体为CO2或SO2,故A正确;
B.溶液与Ba(OH)2反应生成白色沉淀,白色沉淀与足量盐酸反应,沉淀部分溶解,则白色沉淀一定含有BaSO4,即溶液X中一定存在SO42-,故B正确;
C.溶液与Ba(OH)2反应生成白色沉淀,则一定不含Fe3+,若溶液由SO42-、HCO3-、Na+、Mg2+或Cl-构成,则仍与实验现象吻合,所以Mg2+可能含有,故C错误;
D.由上述分析可知,溶液中可能含有Cl-,所以向溶液1(无SO42-)加入硝酸酸化的硝酸银溶液可能生成AgCl白色沉淀,故D正确;
故答案为C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铟(49In)与铷(37Rb)同周期。下列说法错误的是
A. In原子核外有5个电子层B. ![]() In的中子数与电子数的差值为17
In的中子数与电子数的差值为17
C. 碱性:In(OH)3<RbOHD. 原子半径:In>Rb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计如下实验装置用于制备纯净的Cl2。
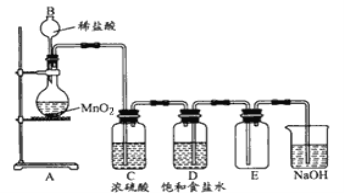
(1)装置中有五处错误,请指出
①_______________
②_______________
③____________________
④_______________________
⑤_______________________
(2)在更正后的装置图中,洗气瓶(净化气体)中的饱和食盐水、浓硫酸、氢氧化钠溶液的作用分别是: ①饱和食盐水的作用:__________②浓硫酸的作用:_________,③氢氧化钠的作用:_____________
(3)将8.7gMnO2与含14.6gHCl的浓盐酸共热制Cl2,甲同学认为可制得7.1gCl2,乙同学认为制得Cl2的质量小于7.1g,你认为_____ (填“甲”或“乙”)同学正确,理由是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。
Ⅰ.制备苯甲酸和回收未反应的甲苯
反应原理:

第1步:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应;
第2步:过滤反应混合物,得到滤液;经过操作Ⅰ,得到有机层和水层;
第3步:向有机层中加无水Na2SO4,过滤,经过操作Ⅱ,得到无色液体A;
第4步:向水层加入浓盐酸酸化,蒸发浓缩,冷却,过滤,得到白色固体B;
已知:
相对分子质量 | 熔点 | 沸点 | 密度 | 溶解度 | |
甲苯 | 92 | -95℃ | 110.8℃ | 0.8669g·mL-1 | 极微溶于水 |
苯甲酸 | 122 | 122.4℃ | 249℃ | 1.2659 g·mL-1 | 0.3g (25℃时) 6.9g (95℃时) |
(1)操作Ⅰ所用的玻璃仪器有烧杯和______________,操作Ⅱ为________________。
(2)第3步中加入无水Na2SO4的目的是_____________________,无色液体A是_______。
Ⅱ.提纯粗苯甲酸
(3)该同学利用重结晶的方法对得到的B进行提纯。重结晶的过程:__________→_________ →_______ →抽滤(与过滤类似)→洗涤→干燥→纯苯甲酸。(注:抽滤装置如图所示,主要仪器有A布氏漏斗,B抽滤瓶,抽气泵等)

(4)白色固体B中的杂质是____________。
(5)趁热抽滤得到的滤液放置冷却可以结晶出纯净的苯甲酸晶体,为了得到更多的苯甲酸,是不是温度越低越好并说明理由______(填“是”或“不是”),理由___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 加酶洗衣粉可以很好地洗涤毛织品上的污渍
B. 以地沟油为原料生产的生物柴油和由石油炼得的柴油都属于烃类物质
C. 氯水放置数天后,漂白性和酸性均减弱
D. “燃煤固硫”、“汽车尾气催化净化”都是利用了化学方法来提高空气质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为某二次电池充电时的工作原理示意图,该过程可实现盐溶液的淡化。下列说法错误的是
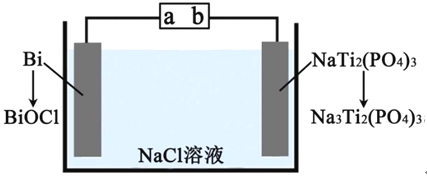
A. 充电时,a为电源正极
B. 充电时,Cl-向Bi电极移动,Na+向NaTi2(PO4)2电极移动
C. 充电时,新增入电极中的物质:n(Na+):n(Cl-)=1:3
D. 放电时,正极的电极反应为BiOCl+2H++3e-=Bi+Cl-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示是由4个碳原子结合成的4种烃(氢原子没有画出)。
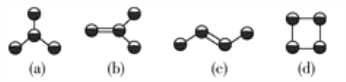
(1)写出有机物(b)的系统命名法的名称:________。
(2)上述有机物中,分子中碳原子一定在同一平面的是______________、______________(填结构简式)。
(3)上述有机物中不能与溴水发生反应使其褪色的有______(填字母代号)。
(4)等质量的上述四种物质完全燃烧耗氧量最大的是______(填结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:

(1)将标准状况下___L氯化氢气体通入1.00L水中可得36.5%的浓盐酸,该浓盐酸中HCl的物质的量浓度为___mol·L-1。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是_____。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol/L的稀盐酸。
①该学生需要量取___mL上述浓盐酸进行配制。
②配制仪器除烧杯、量筒和玻璃棒,还需要的仪器是___、____。
③配制时,下列操作正确的顺序是(用字母表示)____。
A.洗涤 B.定容 C.溶解 D.摇匀 E.冷却 F.称量 G.转移
④在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”或“无影响”)。
Ⅰ.未等稀释后的溶液冷却到室温就转移到容量瓶(______)
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。(______)
Ⅲ.配制时,容量瓶有少量蒸馏水(______)
Ⅳ.定容时仰视刻度线。(_______)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com