
| ���� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| �� | �� | �� | ||||||
| �� | �� | �� | �� | �� | �� | �� | ||
| �� | �� | �� |
 ��
������ ��Ԫ�������ڱ���λ�ÿ�֪���١���ֱ�ΪN��F��Na��Mg��Al��Si��Cl��Ar��K��Br��
��1��ͬ������ϵ��½�������ǿ��ͬ���ڴ������ҽ����Լ�����ͬ������ϵ��·ǽ����Լ�����ͬ���ڴ������ҷǽ�������ǿ��
��2��ϡ����������ʲ����ã�
��3��Ԫ�ص�����������Ӧ��ˮ�����У��������������ǿ��KOH�ļ�����ǿ�����������������ԣ�
��4�����Ӳ�Խ�࣬ԭ�Ӱ뾶Խ��ͬ���ڴ�������ԭ�Ӱ뾶��С��
��5��ͬ������ϵ��¶�Ӧ���ʵĻ����Լ����������õ���֮����û���Ӧ˵����
��� �⣺��Ԫ�������ڱ���λ�ÿ�֪���١���ֱ�ΪN��F��Na��Mg��Al��Si��Cl��Ar��K��Br��
��1������ЩԪ���У���������ǿ��Ԫ����K������õķǽ���Ԫ����F���ʴ�Ϊ��K��F��
��2����ѧ��������õ�Ԫ����Ar����ԭ�ӵ�ԭ�ӽṹʾ��ͼΪ ���ʴ�Ϊ��Ar��
���ʴ�Ϊ��Ar�� ��
��
��3��Ԫ�ص�����������Ӧ��ˮ������������ǿ����HClO4��������ǿ����KOH�������Ե�����������Al��OH��3��
�ʴ�Ϊ��HClO4��KOH��Al��OH��3��
��4��ͬ���ڴ�������ԭ�Ӱ뾶��С�����ڢۡ���Ԫ���У�ԭ�Ӱ뾶������Na��ԭ�Ӱ뾶��С����Cl���ʴ�Ϊ��Na��Cl��
��5���ڢ����ĵ����У���ѧ���ʽϻ��õ���Cl2������2NaBr+Cl2=Br2+2NaCl˵������ʵ���ʴ�Ϊ��Cl2��2NaBr+Cl2=Br2+2NaCl��
���� ���⿼��λ�á��ṹ�����ʣ�Ϊ��Ƶ���㣬����Ԫ�ص�λ�á����ʡ�Ԫ�ػ�����֪ʶΪ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע�������֪ʶ��Ӧ�ã���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������Ƶĵ���ʽ��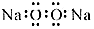 | B�� | �������ƵĽṹʽ��H-Cl-OC | ||
| C�� | �Ȼ�淋ĵ���ʽ��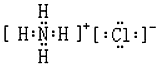 | D�� | �����ӵĽṹʾ��ͼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ������� | ����ʼ���ʵ���mol | ��4���Ӻ�ƽ��ʱ��������mol | ��ƽ��ʱ�ų�������/KJ | |
| ��I2 | ��H2 | ��HI | ||
| ���� | ��0.01 | ��0.01 | ��0.004 | ��Q1 |
| ���� | ��0.02 | ��0.02 | ��a | ��Q2 |
| A�� | �������У�4�����������ķ�Ӧ����Ϊ5.0��10-4rmol/��L•min�� | |
| B�� | ƽ��ʱ���ų���������Q1=4.0��10-3Q kJ | |
| C�� | ƽ���a=8.0��10-3mol��������HI�����������ȼ��и� | |
| D�� | ���¶��£��÷�Ӧ��ƽ�ⳣ��K=0.25 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ�䣨s�� | 0 | 4 | 8 | 12 | 16 | 20 |
| n��N2O4����mol�� | 0.40 | a | 0.20 | c | d | e |
| n��NO2����mol�� | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1mol N2��3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3��Ũ�ȣ�mol•L-1�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | �ų�akJ | ����bkJ | ����ckJ |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com